
【题目】(1)250 mL密度为1.1 g·cm-3、质量分数为24.5%的硫酸跟铁屑充分反应。计算生成H2的体积(标准状况)(给出必要的计算过程)
(2)上述反应中转移电子数目为多少?
(3)亚硝酸钠(NaNO2)具有致癌作用,许多腌制食品中含NaNO2。酸性KMnO4溶液与亚硝酸钠反应的离子反应为 MnO4-+NO2-+H+→Mn2+ + NO3-+H2O(未配平),下列叙述错误的( )
A.生成1mol Mn2+,转移电子为5mol
B.该反应中氮元素被氧化
C.配平后,水的化学计量数为3
D.反应中氧化产物与还原产物的物质的量之比为2:5
(4)向NaOH溶液中逐渐滴入Mg(HCO3)2溶液至沉淀完全的离子方程______________
(5)现有铜片、锌片、导线、小灯泡![]() 、电流表
、电流表![]() 、硫酸铜溶液及烧杯
、硫酸铜溶液及烧杯![]() ,设计实验证明氧化还原反应中有电子转移。要求画图表示及必要的文字说明。
,设计实验证明氧化还原反应中有电子转移。要求画图表示及必要的文字说明。
【答案】(1)15.4L(2)1.4NA(3)D
(4)Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
(5)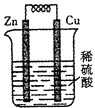 连小灯泡——发亮或电流表 指针偏转
连小灯泡——发亮或电流表 指针偏转
【解析】
试题分析:(1)250 mL密度为1.1 g·cm-3、质量分数为24.5%的硫酸的物质的量是![]() ,所以根据方程式Fe+H2SO4=FeSO4+H2↑可知生成H2的体积为0.6875mol×22.4L/mol=15.4L;
,所以根据方程式Fe+H2SO4=FeSO4+H2↑可知生成H2的体积为0.6875mol×22.4L/mol=15.4L;
(2)上述反应中转移电子的物质的量是0.6875mol×2=1.375mol,其数目约为1.4NA;
(3)A.Mn元素化合价从+7价降低到+2价,因此生成1mol Mn2+,转移电子为5mol,A正确;B.该反应中氮元素化合价从+3价升高到+5价,失去电子被氧化,B正确;C.根据电子得失守恒和原子守恒可知配平后的方程式为2MnO4-+5NO2-+6H+=2Mn2+ +5NO3-+3H2O,C正确;D.根据以上分析可知反应中氧化产物是硝酸根,还原产物是锰离子,二者的物质的量之比为5:2,D错误,答案选D。
(4)向NaOH溶液中逐渐滴入Mg(HCO3)2溶液至沉淀完全的离子方程为Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O;
(5)可以利用原电池中灯泡是否发亮或电流计指针是否偏转判断是否有电子转移。


科目:高中化学 来源: 题型:
【题目】甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。

请回答下列问题:
(1)用化学式表示:丙为 ,H为 。
(2)A的电子式为 。
(3)写出B+C→D的化学方程式 。
写出E+G→F的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O
B.向Ca(HCO3)2溶液中加入足量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O
C.向KHSO4溶液中滴入Ba(OH)2溶液恰好中性:SO42-+H++Ba2++OH-=BaSO4↓+H2O
D.向沸水中滴入饱和氯化铁溶液制取Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 有机物分子中一定含有一个或多个碳原子
B. 有机物分子中的碳原子可以相互连接成链状或环状
C. 有机物分子中的碳原子可以与其它元素的原子连接
D. 分子中含有碳原子的化合物一定是有机化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学―选修2:化学与技术】以硫铁矿(主要成分为FeS2)为原料制取硫酸,其矿渣可用来炼铁。生产工艺示意图如下:
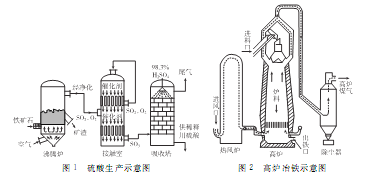
(1)配平煅烧硫铁矿的反应方程式:______FeS2+________O2→_____Fe2O3+______SO2。实际生产中向沸腾炉通入的空气量要大于锻烧硫铁矿所需空气量.其目的是____________________。接触室和热风炉中都装有热交换器,可用反应的余热将通入的气体加热,这样做的好处是_____________________。
(2)生产硫酸时,吸收塔中用98.3%的硫酸吸收而不用水吸收SO3的原因是______________。用含FeS280%的硫铁矿生产硫酸,如果煅烧时有5%的硫损失,SO2转变成SO3的转化率为80%,那么生产98%的浓硫酸3吨,则需要这种硫铁矿___________吨。
(3)CO还原Fe2O3的冶铁过程中,反应物、生成物和温度之间的关系如图所示.
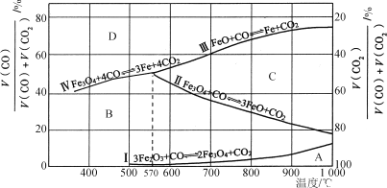
(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
①冶炼高炉产生的高炉煤气的主要成分有__________和剩余的CO。
②据图分析,下列说法正确的是________(填字母)。
a.温度低于570 ℃时,Fe2O3还原焙烧的产物中不含FeO
b.温度越高,Fe2O3还原焙烧得到的固体物质组成中Fe元素的质量分数越高
c.Fe2O3还原焙烧过程中及时除去CO2有利于提高Fe的产率
③800℃时,混合气体中CO2体积分数为40%时,Fe2O3用CO还原焙烧反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中:①pH试纸的使用 ②过滤 ③蒸发 ④配制一定物质的量浓度溶液,均用到的仪器是 ( )
A. 蒸发皿 B. 玻璃棒
C. 试管 D. 分液漏斗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com