
【题目】常温下,用0.1000 mol·L-1 HBr溶液滴定15.00 mL 0.1000 mol·L-1 NaHCO3溶液,滴定曲线如下图所示:
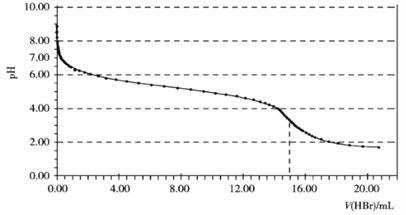
下列说法错误的是
A. 可用甲基橙作指示剂
B. 当V(HBr)=0.00 mL 时,溶液中c(OH-)>c(CO32-)
C. 当 V(HBr)=15.00mL 时,溶液中c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D. 当溶液的pH=7.00时,溶液中c(Na+)=c(Br-)
【答案】D
【解析】A项,甲基橙的变色范围为3.1~4.4之间,由滴定曲线图可看出突变范围包含在其中,所以可用甲基橙作指示剂,故A正确;B项,当V(HBr)=0.00 mL 时,还没有开始滴定,溶液为0.1000 mol·L-1 NaHCO3溶液,由图知溶液显碱性,HCO3- 水解程度大于电离程度,c(OH-)>c(CO32- ),故B正确;C项,当V(HBr)=15.00mL 时,NaHCO3与HBr恰好完全反应,溶液中c(Na+)=c(Br-),生成的CO2一部分溶解在溶液中,根据电荷守恒得:c(Na+)+c(H+)=c(Br-)+c(HCO3-)+2c(CO32-)+c(OH-),所以c(H+)=c(HCO3-)+2c(CO32-)+c(OH- ),故C正确;D项,根据电荷守恒:c(Na+)+c(H+)= c(Br-)+c(HCO3-)+2c(CO32-)+c(OH-),当溶液的pH=7.00时,c(Na+)= c(Br-)+c(HCO3-)+2c(CO32-),所以c(Na+)>c(Br-),故D错误。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是()
A. CO、NO、NO2都是大气污染气体,在空气中都能稳定存在,都不是酸性氧化物
B. N2+3H2![]() 2NH3、N2+O2
2NH3、N2+O2![]() 2NO都属于氮的固定,且N2都表现还原性
2NO都属于氮的固定,且N2都表现还原性
C. 向BaCl2溶液中加入Na2SO3产生沉淀,再通入NO2,沉淀完全溶解
D. 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,该溶液一定含有NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)2NH3(g)
(1)若反应进行到某时刻t时,n1(N2)=13mol,n1(NH3)=6mol,计算a的值.
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%.计算平衡时NH3的物质的量.
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同).n1(始):n1(平)= .
(4)原始混合气体中,a:b= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5 , 它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
A.NH5中既有共价键又有离子键
B.NH5的电子式为 ![]()
C.1 mol NH5中含有5NA个N﹣H键(NA表示阿伏加德罗常数)
D.它与水反应的离子方程式为NH4++H﹣+H2O═NH3H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两个密闭容器A和B,A容器中有一个移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等量的体积比为2:l的SO2和O2的混合气体,并使A和B容积相等(如图所示),在保持400℃的温度下使之发生如下反应:2SO2+O2![]() 2SO3。填写下列空白:
2SO3。填写下列空白:
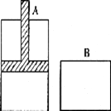
(1)SO2的转化率α(A)______α(B)。(填“<”、“>”或“=”)
(2)达到(1)所述平衡时,若向两容器中通入少量的氩气,A容器化学平衡_________移动。(填“正向”、“逆向”或“不”)
(3)达到(1)平衡后,向容器中充入等量的原反应气体,再次达到平衡后,B容器中SO3在混合气体中的体积分数_______。(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A.乙醇能与钠单质反应说明乙醇属于电解质
B.一般动物脂肪分子中碳碳双键的含量低于植物油分子
C.用小苏打溶液可以区分乙醇、乙酸乙酯和苯
D.在溴化铁的催化作用下,苯与溴水混合易发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com