
【题目】已知:
H2(g)+ ![]() O2(g)═H2O(l)△H=﹣285.8kJ/mol;
O2(g)═H2O(l)△H=﹣285.8kJ/mol;
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣2220.0kJ/mol;
H2O(l)═H2O(g)△H=+44.0kJ/mol.
(1)写出丙烷燃烧生成CO2和气态水的热化学方程式:
(2)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kj,则混合气体中H2和C3H8的体积比为多少?
【答案】
(1)解:已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(1);△H=﹣2220.0kJ/mol
②H2O(1)=H2O(g);△H=+44.0kJ/mol
由盖斯定律可知,①+②×4得C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=﹣2044kJ/mol,
答:丙烷燃烧生成CO2和气态水的热化学方程式C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=﹣2044kJ/mol
(2)解:由热化学方程式可知,氢气的燃烧热为285.8kJ/mol,丙烷的燃烧热为2220.0kJ/mol,H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5KJ,则混合气体中H2和C3H8的平均燃烧热为 ![]() =1252.5kJ/mol,根据十字交叉法计算H2和C3H8的体积比:
=1252.5kJ/mol,根据十字交叉法计算H2和C3H8的体积比: 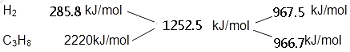
故H2和C3H8的体积比为967.5kJ/mol:966.7kJ/mol=1:1.
答:混合气体中H2和C3H8的体积比为1:1
【解析】(1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式;(2)计算H2和C3H8的平均燃烧热,根据十字交叉法计算H2和C3H8的体积比即可.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】(1)相同温度和压强下,等质量的SO2和O2。二者体积比为________,分子个数比为________,密度比为________。
(2)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是________,CO的体积分数是________,CO的质量分数是________,C和O原子个数比是________,混合气体的平均相对分子质量是________,密度是________g·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物检验方法正确的是( )
A. 取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤素原子存在
B. 用酸性KMnO4溶液检验溴乙烷与NaOH醇溶液共热后的产物是否是乙烯
C. 用溴水鉴别乙烯与乙炔
D. 用NaOH水溶液来鉴别一氯乙烷和三氯乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行化学实验必须注意安全,下列说法中正确的组合是( )
①点燃氢气前要检验氢气的纯度,以免发生爆炸 ②CO气体有毒,处理CO气体时可将其点燃,转化为无毒的CO2 ③在盛O2的集气瓶中进行铁丝燃烧实验时,事先在集气瓶底部铺上一层沙子 ④用氢气还原氧化铜时,先加热再通入氢气,以免浪费氢气 ⑤稀释浓硫酸的操作如下图所示
A.①②③④ B.①②③ C.①②④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷中含有少量乙醇杂质,下列方法中可以除去该杂质的是( )
A. 加入浓硫酸并加热到170℃,使乙醇变成乙烯而逸出
B. 加入氢溴酸并加热,使乙醇转化为溴乙烷
C. 加入金属钠,使乙醇发生反应而除去
D. 加水振荡,静置分层后,用分液漏斗分离去水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2 , 并用阴极排出的溶液吸收NO2 . 下列说法正确的是( ) 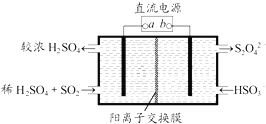
A.a为直流电源的负极
B.阴极的电极反应式为:2HSO3﹣+2H++e﹣═S2O42﹣+2H2O
C.阳极的电极反应式为:SO2+2H2O﹣2e﹣═SO42﹣+4H+
D.电解时,H+由阴极室通过阳离子交换膜到阳极室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的甲、乙、丙三种晶体:

试写出:
(1)甲晶体的化学式(X为阳离子)为________。
(2)乙晶体中A、B、C三种粒子的个数比是________。
(3)丙晶体中每个D周围结合E的个数是________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化镁是一种用途广泛、极具开发前景的环保材料,广泛应用在阻燃、废水中和、烟气脱硫等方面.镁硅酸盐矿石(主要成分Mg3Si2O5(OH)4 , 含氧化铝、氧化铁、氧化亚铁等杂质)可用于生产氢氧化镁,简要工艺流程如图1: 
已知:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(1)对矿石焙烧的目的是 .
(2)加入H2O2溶液反应的离子方程式是 .
(3)向溶液Ⅰ中加入的X可以是 , 作用是 .
(4)加入氨水时,Mg2+转化率随温度t的变化如图2所示: ①溶液Ⅱ中发生反应的离子方程式是 .
②t1前Mg2+转化率增大的原因是;
t1后Mg2+转化率下降的原因是(用化学方程式表示) .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com