
���� ��1����C3H8��g����CH4��g��+HC��CH��g��+H2��g����H1=156.6kJ•mol-1
��CH3CH=CH2��g����CH4��g��+HC��CH��g����H2=32.4kJ•mol-1
���ݸ�˹���ɢ�-�ڵõ�C3H8��g����CH3CH=CH2��g��+H2��g����H=+124.2KJ/mol���ݴ˽��з�����
��2��ȼ�ϵ��ͻ�����ŵ��ǰѻ�ѧ�ܲ���������ֱ��ת��Ϊ���ܣ���˻�ѧ�������ʺܸߣ�һ���ɼ״���CH4O���������Լ�ǿ�����������Һ�������ֻ���أ������ɴﵽ����﮵�ص�ʮ����������ʹ��һ���²ų�һ�ε磮д���õ�ع���ʱ�����ĵ缫��Ӧʽ��
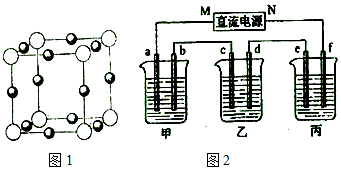
��3��X+�����е������ó���K��L��M�������Ӳ㣬Xԭ�Ӻ��������=2+8+18+1=29����XΪCuԪ�أ��þ����а�ɫС��=8��$\frac{1}{8}$=1����ɫС��=12��$\frac{1}{4}$=3��N3-��3����λ����ɡ�Cu+��1����λ����ɣ������γɵĻ�����ΪCu3N�����ɫС���ʾN3-����ɫС���ʾCu+�����ݾ����ṹͼ���ж���ͬһ��N3-������X+����Ŀ��
��4��e��f�缫Ϊʯī�缫����������������H+�ŵ硢������OH-�ŵ磬����ʵ�����ǵ��H2O����ͨ��Դ������һ��ʱ���ñ���K2SO4Ũ��Ϊ10.47%������װ��ǰ�����ʵ��������䣬����ˮ������Ϊxg�������������������100g��10.00%=��100-x��g��10.47%��x=4.5g��
�ټ������У�a��������b��������������ˮ�õ�������������OH-��b�缫��OH-�ŵ�����������
�ڱ����4.5gˮת�Ƶ������ʵ���=$\frac{4.5g}{18g/mol}$=0.5mol������ת�Ƶ����غ����b�缫���������������
������c�缫������Cu������ͭ������Ϊ�缫�����仯�����ݵ���ת���غ���㣮
��� �⣺��1����C3H8��g����CH4��g��+HC��CH��g��+H2��g����H1=156.6kJ•mol-1
��CH3CH=CH2��g����CH4��g��+HC��CH��g����H2=32.4kJ•mol-1
���ݸ�˹���ɢ�-�ڵõ�C3H8��g����CH3CH=CH2��g��+H2��g����H=+124.2KJ/mol
����ͬ�����£���ӦC3H8��g����CH3CH=CH2��g��+H2��g����H=+124.2KJ/mol��
�ʴ�Ϊ��+124.2��
��2��CH3OH��O2�ڵ���У��϶���O2����CH3OH��CH3OH�Ǹ�����Ӧ�O2��������Ӧ�CH3OH����������CO2��H2O���ʵ缫��ӦʽΪCH3OH+8OH--6e-�TCO32-+6H2O��
�ʴ�Ϊ��CH3OH+8OH--6e-�TCO32-+6H2O��
��3��X+�����е������ó���K��L��M�������Ӳ㣬Xԭ�Ӻ��������=2+8+18+1=29����XΪCuԪ�أ��þ����а�ɫС��=8��$\frac{1}{8}$=1����ɫС��=12��$\frac{1}{4}$=3��N3-��3����λ����ɡ�Cu+��1����λ����ɣ������γɵĻ�����ΪCu3N�����ɫС���ʾN3-����ɫС���ʾCu+��ͬһ��N3-������Cu+��6����
�ʴ�Ϊ��Cu��6��
��4��e��f�缫Ϊʯī�缫����������������H+�ŵ硢������OH-�ŵ磬����ʵ�����ǵ��H2O����ͨ��Դ������һ��ʱ���ñ���K2SO4Ũ��Ϊ10.47%������װ��ǰ�����ʵ��������䣬����ˮ������Ϊxg�������������������100g��10.00%=��100-x��g��10.47%��x=4.5g��
�ټ������У�a��������b��������������ˮ�õ�������������OH-��b�缫��OH-�ŵ������������缫��ӦʽΪ4OH--4e-=2H2O+O2����
�ʴ�Ϊ��4OH--4e-=2H2O+O2����
�ڱ����4.5gˮת�Ƶ������ʵ���=$\frac{4.5g}{18g/mol}$=0.5mol��b�缫��ӦʽΪ4OH--4e-=2H2O+O2��������ת�Ƶ����غ�������������=$\frac{0.5mol}{4}$=2.8L��
�ʴ�Ϊ��2.8L��
������c�缫������Cu������ͭ������Ϊ�缫�����仯����������ת�Ƶ���Ϊ0.5mol�����ݵ���ת���غ㣬����n��Cu��=$\frac{0.5mol}{2}$=0.25mol����m��Cu��=0.25mol��64g/mol=16g��
�ʴ�Ϊ��16��
���� ���⿼�鷴Ӧ�ȵļ��㣬���ʽṹ�����ʣ��漰�������㣬���ԭ����Ϊ��Ƶ���㣬���ؿ���ѧ�������жϼ�������������ȷ�缫���Ƽ������缫�Ϸ����ĵ缫��Ӧʽ�ǣ�4���Ȿ��ؼ��������Ѷ��еȣ�


 һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
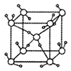
| A�� | 2 | B�� | 4 | C�� | 8 | D�� | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ��X2Y�Ľṹʽ
��X2Y�Ľṹʽ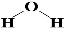 ��
��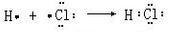 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
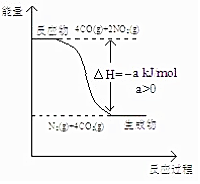 �о� NOx��SO2��CO �ȴ�����Ⱦ����Ĵ���������Ҫ���壮
�о� NOx��SO2��CO �ȴ�����Ⱦ����Ĵ���������Ҫ���壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
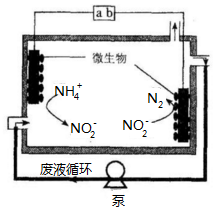 �����ⷨ�����ڴ�����ˮ���乤��ԭ����ͼ��ʾ������˵����ȷ���ǣ�������
�����ⷨ�����ڴ�����ˮ���乤��ԭ����ͼ��ʾ������˵����ȷ���ǣ�������| A�� | aΪ��Դ�ĸ��� | |
| B�� | �Ҳ�缫��ӦʽΪ��2NO2-+6e-+4 H+=N2��+4OH- | |
| C�� | ��ع���һ��ʱ�����Һ��NO2-��Ũ�Ȳ��� | |
| D�� | ÿͨ��3mol���ӣ���ദ��0.5mol NH4+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ᴿ�����еĵ�����ʱ����������Һ�м���Ũ���ᣬȻ�����ó����˳������ýϴ��ĵ����� | |
| B�� | ���ù��˵ķ�����ȥ���Ȼ�̼�е�I2 | |
| C�� | �����屽�Ļ������÷�Һ©����Һ���� | |
| D�� | ���������л������ᣬ���ñ���Na2CO3��Һϴ�ӣ�Ȼ���Һ������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
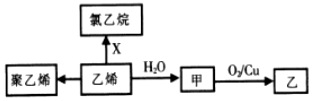
| A�� | 1mol����ϩ���е�ԭ����ĿΪ6NA | B�� | CH3OCH3���Ϊͬ���칹�� | ||
| C�� | XΪC12 | D�� | �ס��ҷ�Ӧ����Ϊȡ����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ˮ��Һ�����ԣ�������ˮ��Һһ�������ˮ��Һ | |
| B�� | Fe3O4��д��FeO?Fe2O3��Pb3O4Ҳ��д��PbO?Pb2O3 | |
| C�� | ��ҵ��ͨ���������MgCl2����ȡ����þ��Ҳ����ͨ���������AlCl3����ȡ������ | |
| D�� | ��2����Ԫ���⻯���ȶ���˳����HF��H2O��NH3�����3����Ԫ���⻯���ȶ���˳����HCl��H2S��PH3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com