
无机化合物可根据其组成和性质进行分类:
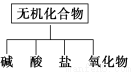
(1)下图所示的物质分类方法名称是________
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | HCl②____ | ③___④Ba(OH)2 | ⑤Na2CO3⑥____ | ⑦CO2⑧Na2O2 |
(3)写出⑦转化为⑤的化学方程式_____________________________
(4)呼吸面具中用⑧作为O2来源的反应原理为:___________________________
(5)实验室制备⑦常用________和________反应,检验该气体的方法是____________
(1)树状分类法
(2)②H2SO4 ③NaOH ⑥K2CO3(合理即可)
(3)2NaOH+CO2=Na2CO3+H2O
(4)2Na2O2+2CO2=2Na2CO3+O2,
2Na2O2+2H2O=4NaOH+O2↑
(5)CaCO3 稀盐酸 通入澄清石灰水,若变浑浊,则生成的气体为CO2
【解析】(1)常见的分类法有两种:交叉分类法和树状分类法,由图可知为树状分类法。
(2)酸可填写H2S、H2SO4、HNO3、H2CO3中的一种,碱可填写KOH、NaOH中的一种,盐可填写K2SO4、K2CO3、NH4NO3等中的一种。
(3)CO2是酸性氧化物,可与NaOH反应生成Na2CO3。
(4)Na2O2和H2O、CO2反应都能产生O2。
(5)CaCO3和稀盐酸反应,产生的CO2气体可用澄清石灰水来检验。


科目:高中化学 来源:2014年高考化学一轮复习课后规范训练3-3练习卷(解析版) 题型:填空题
A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C
为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去)。
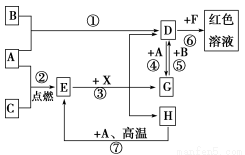
(1)写出化学式:A________、D________、E________、X________。
(2)在反应①~⑦中,不属于氧化还原反应的是________(填编号)。
(3)反应⑥的离子方程式为:_______________________________________。
(4)反应⑦的化学方程式为_________________________________________;
该反应中每消耗0.3 mol的A,可转移电子______mol。
(5)写出D的溶液与小苏打溶液反应的离子方程式:_________________________
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练2-3练习卷(解析版) 题型:填空题
消毒剂在生产生活中有极其重要的作用,开发具有广普、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2C.ClO2 D.O3
(2)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为________,H2O2被称为“绿色氧化剂”的理由是____________________________________
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为________。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是__________________(用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练2-2练习卷(解析版) 题型:选择题
有一混合溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32—、SO42—,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加入足量NaOH溶液加热后,收集到气体0.06 mol;
(3)第三份加入足量BaCl2溶液后,所得沉淀经洗涤、干燥、称量为6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是( )
A.K+一定存在
B.100 mL溶液中含0.01 mol CO32—
C.Cl-可能存在
D.Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练2-2练习卷(解析版) 题型:选择题
欲将混合液中Al3+、Cu2+、Ba2+、Ag+逐一沉淀出来加以分离,加入试剂①Cl- ②SO42—
③OH- ④CO2⑤CO32—的正确顺序是( )
A.①②③④ B.③⑤①②
C.②①③⑤ D.①⑤③②
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练2-1练习卷(解析版) 题型:选择题
在一定条件下,跟酸、碱、盐都能发生反应的物质是( )
A.K2O B.Na2CO3C.CaCO3 D.CO2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-3练习卷(解析版) 题型:填空题
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
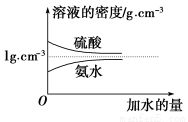
| 溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为________mol·L-1。
(3)物质的量浓度为c2 mol·L-1的氨水与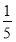 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________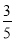 c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-2练习卷(解析版) 题型:填空题
(1)由三个原子构成的某气体分子,其摩尔质量为M g/mol,该气体的体积为V L(标准
状况),设阿伏加德罗常数的值为NA,则:
①该气体的物质的量为________mol;
②该气体中所含的原子总数为________个;
③该气体在标准状况下的密度为________g/L;
④该气体的一个分子的质量为________g。
(2)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为________,推断的依据为______________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型四 离子反应型专题练习卷(解析版) 题型:选择题
下列离子方程式正确的是( )
A.小苏打溶液中加入少量石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.稀硝酸中加入少量铁粉:Fe+2H++NO3-=Fe3++NO↑+H2O
C.溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com