
用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO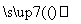 3Ba↑+BaO·Al2O3
3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性______(选填“强”、“弱”)。利用上述方法可制取Ba的主要原因是______。
A.高温时Al的活泼性大于Ba
B.高温有利于BaO分解
C.高温时BaO·Al2O3比Al2O3稳定
D.Ba的沸点比Al的低
科目:高中化学 来源: 题型:
一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________________________。
③该储氢装置的电流效率η=________。(η=生成目标产物消耗的电子数/转移的电子总数×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是( )
A.Fe(OH)3 Fe2O3 B.Fe(OH)2 Fe2O3
C.Fe(OH)2 Fe(OH)3 D.Fe(OH)2 Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x的值:__________________(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备,FeCl3可用铁粉和__________反应制备。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁的氧化物有多种用途。请解答下面有关问题:
(1)赤铁矿的主要成分是Fe2O3,是工业炼铁的主要原料之一。写出由Fe2O3制得单质铁的化学方程式______。某赤铁矿除了含Fe2O3之外,还含有少量的SiO2和Al2O3。将试样溶于NaOH溶液,充分反应后过滤,即可得到较纯净的Fe2O3。该过程中发生反应的离子方程式是____________________________________________________________。
(2)Fe2O3可以与铝粉组成铝热剂用于焊接钢轨或定向爆破。某同学猜测,该反应所得熔融物中含有Fe2O3。他设计如下实验来验证自己的猜想:取少量试样,加入足量稀盐酸,然后滴加KSCN溶液,若出现血红色,证明含有Fe2O3。否则,不含有Fe2O3。你认为该方案合理吗?为什么?
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是人类应用较早,当前应用量最大的金属元素。下列有关铁及其化合物的有关说法中正确的是( )
A.赤铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
D.Fe3+与KSCN产生血红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
钓鱼岛群岛的东海海域及部分太平洋海域探明为海底热水矿床。海底热水矿床是沉积着由岩浆热气从地底喷出的金、铜、锌、稀有金属等区域。下列说法正确的是( )
A.金不溶于任何溶液
B.铜、锌在空气中均能被氧化成对应的氧化物
C.铜锌合金的熔点低于铜或锌的熔点
D.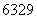 Cu的质子数和中子数之差为34
Cu的质子数和中子数之差为34
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)糖类、油脂、蛋白质能在人体中被__________(填“氧化”或“还原”),供给人体所需要的能量。根据溶解性的不同,维生素B类属于______________性维生素,维生素D属于________性维生素。
(2)下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上。
| 品 名 | ××× |
| 配 料 | 鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、食盐、柠檬汁等 |
| 保质期 | 240天 |
| 生产日期 | 标于包装袋封口上 |
①富含蛋白质的是_________________________________________。
②富含糖类的是_______________________________________________。
③富含油脂的是______________________________________________。
④富含维生素的是________________________________________________。
(3)某肉制品包装上印有相关配料:精选瘦肉、食盐、亚硝酸钠、苯甲酸钠。其中属于调味剂的是__________________________________________,
属于防腐剂的是____________。
(4)亚硝酸钠有毒,其外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故。亚硝酸钠和氯化钠的部分性质如下表:
| 性 质 | 亚硝酸钠 | 氯化钠 |
| 酸性条件下的稳定性 | 微热时分解为NO和NO2 | 微热时不分解 |
| 熔 点 | 271 ℃ | 801 ℃ |
| 室温时的溶解度 | 约80 g | 约35 g |
请根据表中信息设计一种鉴别NaNO2和NaCl的方法,写出简单的操作过程、现象和结论:___________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是 ( )
A.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
B.甲烧杯中的酸过量
C.两烧杯中参加反应的锌不等量
D.反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com