
| t/K | 300 | 400 | 500 | … |
| K/(mol•L-1)2 | 4×106 | 8×107 | K1 | … |
分析 (1)根据平衡常数的定义判断反应的方程式;
(2)计算浓度商和平衡常数减小比较判断反应进行的方向,若Q=K,反应达到平衡,Q<K,反应正向进行,Q>K反应逆向进行;使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,需要改变条件 满足化学反应速率增大,且平衡正向进行;
(3)分析图表平衡常数温度升高,平衡常数增大,平衡正向进行,正反应为吸热反应;结合平衡移动原理分析,正逆反应速率相同,各组分含量保持不变分析选项.
解答 解:(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,平衡常数中,分子为生成物,分母为反应物,再结合质量守恒定律,所以该反应的方程式为C(s)+H2O(g)?CO(g)+H2(g),
故答案为:C(s)+H2O(g)?CO(g)+H2(g);
(2)一段时间后,当N2、H2、NH3的物质的量分别为2mol/L、1mol/L、2mol/L时,Qc=$\frac{4×4}{4×{2}^{3}}$=0.5,所以该状态是平衡状态,正逆反应速率相等,
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,
a.反应是气体体积减小的反应,缩小体积增大压强,反应速率增大,平衡逆向进行,故a正确;
b.反应是放热反应,升高温度,速率增大,平衡逆向进行,故b错误;
c.加催化剂改变反应速率,不改变平衡,故c错误;
d.使氨气液化移走,平衡正向进行,反应速率减小,故d错误;
故答案为:=;a;
(3)①图表分析可知,平衡常数随温度升高增大,说明正反应为吸热反应,△H>0,
故答案为:>;
②A(g)+3B(g)?2C(g)+D(s)△H>0,
a.反应速率之比等于化学方程式计量数之比,2v(B)(正)=3v(C)(逆),说明C的正逆反应速率相同,反应达到平衡状态,但3v(B)(正)=2v(C)(逆)不能说明反应达到平衡状态,故a错误;
b.A和B的转化率相等与起始量、变化量有关,不能说明反应达到平衡状态,故b错误;
c.反应前后气体体积减小,容器内压强保持不变,说明反应达到平衡状态,故c正确;
d.反应前后气体质量减小,体积不变,混合气体的密度保持不变说明反应达到平衡状态,故d正确;
故答案为:cd.
点评 本题考查根据化学平衡常数书写化学方程式、平衡移动相关计算等,题目较为综合,涉及多方面的知识,题目难度中等,注意平衡标志判断.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:实验题
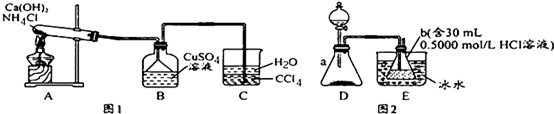
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
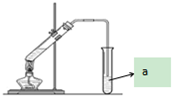 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: ,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;
,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 | 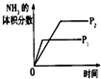 | 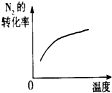 | 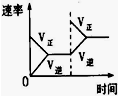 | 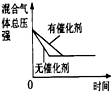 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.00 | 18.50 |
| 2 | 0.00 | 22.45 |
| 3 | 0.00 | 18.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | |
| C. | NaClO和NaOH的混合溶液中通入少量的SO2:ClO-+H2O+SO2=C1-+SO42-+2H+ | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2是氧化剂,NaOH是还原剂 | |
| B. | Br2既是氧化剂又是还原剂 | |
| C. | 被氧化的Br原子和被还原的Br原子的物质的量的比为5:1 | |
| D. | 每生成1mol的NaBrO3转移10mol的电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com