
【题目】CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5~4.5 ℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响。如何合理地利用CO2是摆在科学家面前的一个重大课题。回答下列问题:
(1)工业上利用高温、高压条件,可用CO2与NH3合成尿素[CO(NH2)2],该反应的化学方程式为___。
(2)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
CO2的量 | NaOH溶液的量 | 放出的热量 | |
① | 22.0 g | 750 mL 1.0 mol·L-1 | x kJ |
② | 1.0 mol | 2.0 L 1.0 mol·L-1 | y kJ |
写出该条件下CO2与NaOH溶液反应生成NaHCO3的热化学方程式: ___________________。
(3)在一定温度和催化剂作用下,可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) ΔH。当300 ℃时,一定量的CO2和H2混合气体在容积为2 L的恒容密闭容器中发生上述反应,5 min后达到平衡,此时各物质的浓度如下表:
CH4(g)+2H2O(g) ΔH。当300 ℃时,一定量的CO2和H2混合气体在容积为2 L的恒容密闭容器中发生上述反应,5 min后达到平衡,此时各物质的浓度如下表:
物质 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
浓度/mol·L-1 | 0.2 | 0.8 | a | 1.6 |
则平衡时容器中甲烷的物质的量n(CH4)=________。从反应开始到达到平衡时的化学反应速率v(CH4)=__________。500 ℃时该反应的平衡常数K=16,则该反应的ΔH__________(填“>”“<”)0。
(4)CO2还可用于生产甲醇,一定条件下,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH。
CH3OH(g)+H2O(g) ΔH。
①在容积为2 L的恒容密闭容器中,通入2 mol CO2和3 mol H2发生上述反应,下列说法能够表明该可逆反应达到平衡状态的是__________(填字母)。
a.消耗3 mol H2(g)时,有1 mol CH3OH(g)生成
b.转移3 mol电子时,反应的CO2为11.2 L(标准状况)
c.体系中气体的密度不变
d.水蒸气的体积分数保持不变
e.单位时间内生成H2(g)与生成H2O(g)的物质的量之比为3∶1
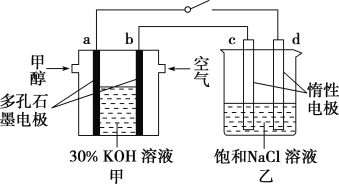
②用多孔石墨作电极,30% KOH溶液作电解质溶液,可设计如图甲所示的甲醇燃料电池,该电池的负极反应式为______________________________。若将该燃料电池与电解饱和食盐水的装置进行串联(如图),当有0.12 mol 电子发生转移时,断开电源,将溶液冷却至室温,测得食盐溶液为120 mL,则此时乙装置中溶液的pH=________(假设食盐水中有足量的NaCl,且Cl2完全逸出)。
【答案】CO2+2NH3![]() CO(NH2)2+H2O CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1 1.6 mol 0.16 mol·L-1·min-1 < de CH3OH-6e-+8OH-=CO32-+6H2O 14
CO(NH2)2+H2O CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1 1.6 mol 0.16 mol·L-1·min-1 < de CH3OH-6e-+8OH-=CO32-+6H2O 14
【解析】
(1)CO2与NH3合成尿素,其反应方程式为CO2+2NH3![]() CO(NH2)2+H2O;
CO(NH2)2+H2O;
答案为CO2+2NH3![]() CO(NH2)2+H2O;
CO(NH2)2+H2O;
(2)22.0 g CO2的物质的量为![]() =0.5 mol,n(NaOH)=1.0 mol·L-1×0.75 L=0.75 mol,即n(CO2)∶n(NaOH)=2∶3,此时的热化学方程式为2CO2(g)+3NaOH(aq)=NaHCO3(aq)+Na2CO3(aq)+H2O(l) ΔH=-4x kJ·mol-1 Ⅰ;n(CO2)=1.0 mol,n(NaOH)=1.0 mol·L-1×2.0 L=2.0 mol,即n(CO2)∶n(NaOH)=1∶2,此时的热化学方程式为2NaOH(aq)+CO2(g)=Na2CO3(aq)+H2O(l) ΔH=-y kJ·mol-1 Ⅱ;根据盖斯定律,Ⅰ-Ⅱ可得目标热化学方程式:NaOH(aq)+CO2(g)=NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1;
=0.5 mol,n(NaOH)=1.0 mol·L-1×0.75 L=0.75 mol,即n(CO2)∶n(NaOH)=2∶3,此时的热化学方程式为2CO2(g)+3NaOH(aq)=NaHCO3(aq)+Na2CO3(aq)+H2O(l) ΔH=-4x kJ·mol-1 Ⅰ;n(CO2)=1.0 mol,n(NaOH)=1.0 mol·L-1×2.0 L=2.0 mol,即n(CO2)∶n(NaOH)=1∶2,此时的热化学方程式为2NaOH(aq)+CO2(g)=Na2CO3(aq)+H2O(l) ΔH=-y kJ·mol-1 Ⅱ;根据盖斯定律,Ⅰ-Ⅱ可得目标热化学方程式:NaOH(aq)+CO2(g)=NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1;
答案为NaOH(aq)+CO2(g)=NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1;
(3)根据化学方程式中CH4与H2O的化学计量数的关系可计算c(CH4)=![]() =0.8 mol·L-1,平衡时容器中的甲烷的物质的量n(CH4)=0.8 mol·L-1×2 L=1.6 mol;v(CH4)=
=0.8 mol·L-1,平衡时容器中的甲烷的物质的量n(CH4)=0.8 mol·L-1×2 L=1.6 mol;v(CH4)=![]() =0.16 mol·L-1·min-1;300 ℃时,平衡常数K=
=0.16 mol·L-1·min-1;300 ℃时,平衡常数K=![]() =25>16,即300 ℃时的平衡常数比500 ℃时大,由此可见升温时,平衡逆向移动,故正反应为放热反应,即ΔH<0;
=25>16,即300 ℃时的平衡常数比500 ℃时大,由此可见升温时,平衡逆向移动,故正反应为放热反应,即ΔH<0;
答案为1.6 mol;0.16 mol·L-1·min-1;<;
(4)①a、消耗H2,生成CH3OH,反应方向都是向正反应方向进行,因此消耗3molH2,生成1molCH3OH,不能说明反应达到平衡,故a不符合题意;
b、反应的任何时间,都有转移3mol电子时,反应的CO2为11.2L(标况下),不能说明反应达到平衡,故b不符合题意;
c、组分都是气体,气体总质量不变,容器为恒容,气体体积不变,因此气体密度不变,不能说明反应达到平衡,故c不符合题意;
d、根据化学平衡的定义,当水蒸气的体积分数不再改变,说明反应达到平衡,故d符合题意;
e、生成H2,反应向逆反应方向进行,生成H2O,反应向正反应方向进行,且3:1等于化学计量数之比,因此单位时间内生成H2(g)与生成H2O(g)的物质的量比为3∶1,能说明反应达到平衡,故e符合题意;
答案为de;
②负极上CH3OH被氧化生成CO2,CO2与溶液中的OH-反应生成CO32-,故负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;电解饱和食盐水的阴极反应式为2H2O+2e-=2OH-+H2↑,转移0.12 mol电子时,生成的n(NaOH)=n(e-)=0.12 mol,c(OH-)=![]() =1 mol·L-1,c(H+)=
=1 mol·L-1,c(H+)=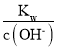 =10-14 mol·L-1,pH=-lg10-14=14;
=10-14 mol·L-1,pH=-lg10-14=14;
答案为CH3OH-6e-+8OH-=CO32-+6H2O;14。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
下列说法正确的是( )
A. 升高温度,若W的体积分数减小,则此反应ΔH>0
B. 该温度下,此反应的平衡常数K=6.75
C. 增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D. 该温度下,再向该容器中加入1.5 mol W,达到新平衡时,c(X)=0.25 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H为中学化学中常见的物质,其转化关系如图所示,其中“〇”代表化合物,“□”代表单质,A为医学上治疗胃酸过多的一种药剂,G为淡黄色固体,C在通常状况下为无色液体,F为金属单质。请回答下列问题:

(1)G的化学式为________,G中阴阳离子个数比为______,每生成1mol G转移电子物质的量为________ 。
(2)A、D的水溶液均呈_______(填酸性、碱性或中性),反应①②③④中属于氧化还原反应的有_______个。
(3)写出下列反应的化学方程式。
A→B+C+D:__________________,
F+C:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示渗透作用装置图,其中半透膜为膀胱膜,甲、丙装置中A、B、a、b溶液浓度分别用MA、MB、Ma、Mb表示,乙、丁装置分别表示一段时间后甲、丙装置的状态,液面上升的高度分别为h1、h2。如果A、B、a、b均为蔗糖溶液,且MA>MB,Ma=Mb>MA,则达到平衡后( )
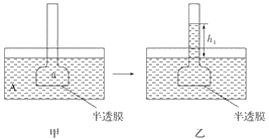

A. h1>h2、Ma>MbB. h1>h2、Ma<Mb
C. h1<h2、Ma<MbD. h1<h2、Ma>Mb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. MnO2+ 4HCl(浓)![]() MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
B. 2H2S+ SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为1∶1
C. 3S+ 6KOH=2K2S+ K2SO3+3H2O中,被氧化和被还原的硫元素物质的量之比为2∶1
D. Al2O3+N2+3C![]() 2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2+ +2OH- ![]() CH3COONH4 +3NH3+2Ag↓+H2O
CH3COONH4 +3NH3+2Ag↓+H2O
B. 苯酚钠溶液中通入少量CO2:CO2 +H2O+2C6H5O-→2C6H5OH+CO32-
C. 氯乙烷中滴入AgNO3溶液检验其中氯元素:Cl-+Ag+=AgCl↓
D. 乙酸滴入氢氧化铜悬浊液中:2CH3COOH+Cu(OH)2=Cu2++2CH3COO-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在碱性醇溶液中能发生消去反应。
例如,![]()
该反应式也可表示为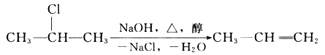
下面是几种有机化合物的转化关系:
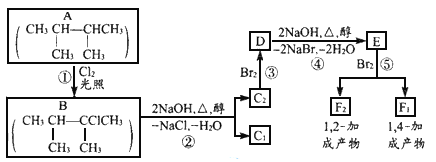
(1)根据系统命名法,化合物A的名称是_____________。
(2)反应①的反应类型_________,反应③的反应类型___________
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:_______。
(4)C1的结构简式是______________,F1的结构简式是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)=2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=___kJ·mol-1(用含a、b的代数式表示);
(2)已知2SO2(g)+O2(g)=2SO3(g) △H反应过程的能量变化如图所示,已知1molSO2(g)氧化为1molSO3放出99kJ的热量,请回答下列问题:
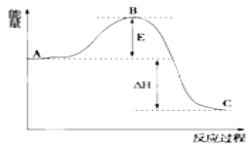
①图中A分别表示____;
②E的大小对该反应的反应热____(填“有”或“无”)影响;
③该反应通常用V2O5作催化剂,加V2O5会使图中B点____(填“升高”“降低”)。
Ⅱ.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活中的主要能源物质。请回答下列问题:
(3)有机物M经过太阳光光照可转化成N,转化过程如图:
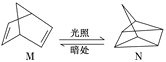 ΔH=+88.6 kJ/mol
ΔH=+88.6 kJ/mol
则M、N相比,较稳定的是___。
(4)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-akJ/mol,则a__238.6(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属是非常有用的材料,以下是四种金属的相关性质。
金属 | 熔点(℃) | 密度(g/cm3) | 相对强度 (1表示很弱) | 相对硬度 (1表示很软) | 每吨价格 (元) |
铝 | 660 | 2.7 | 11 | 2.8 | 11400 |
铜 | 1085 | 8.9 | 33 | 3.0 | 38000 |
铁 | 1538 | 7.9 | 20 | 4.5 | 4000 |
钛 | 1668 | 4.5 | 40 | 6.0 | 160000 |
完成下列填空:
(1)铝用作电线是利用了铝的_________性;铁用作炊具是利用了铁的_________性。
(2)工业上常以Cu为原料制备CuSO4,“绿色化学”要求从经济、技术和环保来设计可行的化学反应,生产应尽量减少对环境的副作用。下列反应符合“绿色化学”的是(_______)
A.Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑ + 2H2O
CuSO4 + SO2↑ + 2H2O
B.2Cu + O2![]() 2CuO,CuO + H2SO4→CuSO4 +H2O
2CuO,CuO + H2SO4→CuSO4 +H2O
(3)常温下由于浓硫酸能使铁___________,因此浓硫酸可用铁槽车运输。
(4)钛是制造飞机的材料之一。根据表中数据,解释为何用钛来制造飞机。______________
(5)钢是主要含有铁的合金。汽车车身可以用铝或钢制造。已知铁在潮湿的空气中会迅速腐蚀,而铝不会。请解释铝耐腐蚀的原因。_______________________________________
(6)根据表中数据,描述用铝来取钢制造汽车车身的一项优点和一项缺点。
优点:_____________________________________________________________________
缺点:_____________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com