
【题目】在恒容密闭容器中发生反应2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)。在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法正确的是( )

A. 323 K时,缩小容器体积可提高SiHCl3的转化率
B. a、b点对应的反应速率大小关系:v(a)<v(b)
C. 343 K时,上述反应的化学平衡常数约为0.02
D. 2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)的正反应为吸热反应
【答案】CD
【解析】
A. 反应是气体体积不变的体系;
B. 温度越高,反应速率越快;
C. 设SiHCl3的起始浓度为1 mol/L,列出三段式,根据平衡常数的表达式计算作答;
D. 根据图像分析易知,升高温度, SiHCl3的转化率增大,据此作答。
A. 2SiHCl3(g) ![]() SiH2Cl2(g)+SiCl4(g)反应中,气体的体积保持不变,则缩小容器体积增大压强平衡不移动,提高SiHCl3的转化率不变,故A项错误;
SiH2Cl2(g)+SiCl4(g)反应中,气体的体积保持不变,则缩小容器体积增大压强平衡不移动,提高SiHCl3的转化率不变,故A项错误;
B. a、b点对应的SiHCl3的转化率相等,根据先拐先平数值大原则可知,a点对应的温度高,则其反应速率v(a)>v(b),故B项错误;
C. 343 K时,SiHCl3的平衡转化率为22%,设SiHCl3的起始浓度为1 mol/L,则转化的SiHCl3物质的量浓度为1 mol/L×22% = 0.22 mol/L,列出三段式如下:
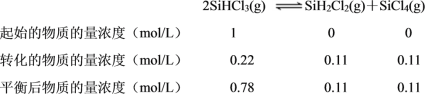
因此343 K时,上述反应的化学平衡常数 = ![]() 0.02,故C项正确;
0.02,故C项正确;
D. 从图中可看出,升高温度,有利于SiHCl3的转化,则平衡向正反应方向移动,说明2SiHCl3(g) ![]() SiH2Cl2(g)+SiCl4(g)正反应为吸热反应,故D项正确;
SiH2Cl2(g)+SiCl4(g)正反应为吸热反应,故D项正确;
答案选CD。


科目:高中化学 来源: 题型:
【题目】硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析不正确的是
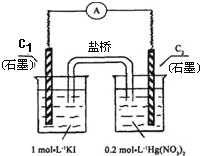
A. 如图装置的电流方向是从C2到C1
B. C1附近加入淀粉变蓝,C2析出固体
C. 可用饱和KI溶液—琼脂填充盐桥增强导电性
D. 该装置内发生的氧化还原反应可自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
A. 用 所示装置分离CCl4和I2的混合物
所示装置分离CCl4和I2的混合物
B. 用 所示装置获取少量SO2气体
所示装置获取少量SO2气体
C. 用 所示装置除去CO2气体中的少量SO2
所示装置除去CO2气体中的少量SO2
D. 用 所示装置蒸发NaCl溶液获得NaCl晶体
所示装置蒸发NaCl溶液获得NaCl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 常温常压下,11.2L二氧化硫所含的氧原子数等于NA
B. 0.5molH2O所含的电子数为9NA
C. 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA
D. 300mL2mol·L-1蔗糖溶液中所含分子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2A为二元弱酸。20℃时,配制一组c(H2A)+c(HA﹣)+c(A2﹣)=0.100molL﹣1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
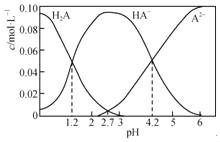
A. H2A的Ka1=10﹣1.2
B. pH=4.2的溶液中:c(HA﹣)=c(A2﹣)=0.050 molL﹣1
C. pH=7的溶液中:c(Na+)>2c(A2﹣)+c(H+)
D. c(Na+)=0.150 molL﹣1的溶液中:2c(OH﹣)+c(HA﹣)+3c(H2A)=2c(H+)+c(A2﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用Na2CO3固体配制950mL 0.1 mol·L-1的Na2CO3溶液。配制过程如下图所示
请根据题意回答:
(1)配制该溶液应选用__________mL容量瓶。
(2)用托盘天平称取_________g固体Na2CO3固体。
(3)向容量瓶中加入蒸馏水,直到液面在刻度线下1~2cm时,改用____________滴加蒸馏水至液面的最低点与刻度线相切,盖好瓶塞,摇匀。
(4)在配制上述溶液的实验中,下列操作中会引起结果偏低的有____________(填序号)
A.在烧杯中搅拌溶解溶质时,溅出少量溶液
B.未将洗涤烧杯内壁的溶液转移至容量瓶
C.定容时,加水超过了刻度线,倒出一些再重新加水至刻度线
D.将所配溶液从容量瓶转移到试剂瓶时有少量溶液溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g)![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=_________。分别在v L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
(2)CO2可以被NaOH溶液捕获。
①若所得溶液pH=13,CO2主要转化为_______(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×107;K2=5×1011)
②当2molCO2通入3molNaOH被吸收时,溶液中离子浓度关系正确的是(选填字母)________。
a.c(Na+)+c(H+)=c(CO32)+c(HCO3-)+c(OH-)
b.c(Na+)>c(HCO3-)>c(CO32)> c(OH-)>c(H+)
c.3c(Na+)=2[c(CO32)+c(HCO3-) +c(H2CO3)]
(3)CO2辅助的CO—O2燃料电池,工作原理如图所示,固体介质中CO32— 可定向移动。电池的负极反应式:________________________________电池工作时需向某电极通入CO2以触发反应,该电极为_____________(填“甲”或“乙”)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量比为16∶7∶6的三种气体SO2、CO、NO,分子个数之比为_____________;氧原子个数之比为____________。
(2)在标准状况下,6.8g PH3与标准状况下_______L CH4含有相同数目的H原子。
(3)某气体氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为________,R的相对原子质量为________。
(4)273 K、1.01×105 Pa时气态单质X2的密度为1.25 g·L-1,则X的相对原子质量为________
(5)相同温度和压强条件下,一定体积的气态氢化物H2R的质量是等体积NH3的2倍,则R的相对原子质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为________________________________。
(2)某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因__________________________________________。
II.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作
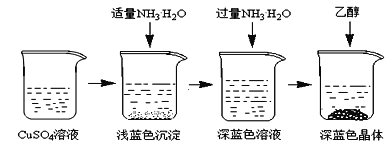
(3)已知浅蓝色沉淀的成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式___________________。
(4)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是________________________。
III.氨含量的测定
精确称取wg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/L NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。
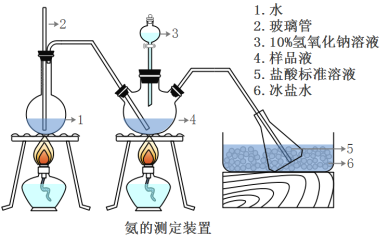
(5)A装置中长玻璃管的作用_________________,样品中氨的质量分数的表达式_______。
(6)下列实验操作可能使氨含量测定结果偏高的原因是____________________。
A.滴定时未用NaOH标准溶液润洗滴定管。
B.读数时,滴定前平视,滴定后俯视。
C.滴定过程中选用酚酞作指示剂。
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com