
 ԭ���������������X��Y��Z��G��Q��R��T����Ԫ�أ��˵������С��36����֪X��һ�֣�1��2���⻯������м��ЦҼ����Цм���������ԭ�ӹ�ƽ�棻Z��L������2��δ�ɶԵ��ӣ�Qԭ�ӵ�s�ܼ���p�ܼ���������ȣ�R������������ּ���������Ӳ�Ʒ�ĺ��IJ��ϣ�T�������ڱ���ds����ԭ����ֻ��һ��δ�ɶԵ��ӣ�
ԭ���������������X��Y��Z��G��Q��R��T����Ԫ�أ��˵������С��36����֪X��һ�֣�1��2���⻯������м��ЦҼ����Цм���������ԭ�ӹ�ƽ�棻Z��L������2��δ�ɶԵ��ӣ�Qԭ�ӵ�s�ܼ���p�ܼ���������ȣ�R������������ּ���������Ӳ�Ʒ�ĺ��IJ��ϣ�T�������ڱ���ds����ԭ����ֻ��һ��δ�ɶԵ��ӣ�| ������ | G�ķ����� | Q�ķ����� | R�ķ����� |
| �۵�/K | 993 | 1539 | 183 |
���� X��һ��1��2���⻯������м��ЦҼ����Цм�������ԭ�ӹ�ƽ�棬˵�����⻯���к���˫�����������⻯������ϩ�к��ЦҼ��ͦм�������1��2���⻯�����x��CԪ�أ�Z��L������2��δ�ɶԵ��ӣ���L������6�����ӣ�����ZΪOԪ�أ�Qԭ��s�ܼ���P�ܼ���������ȣ���Q�ĵ����Ų�Ϊ1s22s22p63s2������QΪMgԪ�أ�R������������ּ���������Ӳ�Ʒ �ĺ��IJ��ϣ���RΪSiԪ�أ�T�������ڱ���ds����ԭ����ֻ��һ��δ�ɶԵ��ӣ���TΪCuԪ�أ�X��Y��Z��G��Q��R��Tԭ��������������YΪNԪ�أ�G���γɷ��������ԭ������С��Mg����GΪNaԪ�أ���������Ԫ�ص����ʣ����ѡ��������
��� �⣺X��һ��1��2���⻯������м��ЦҼ����Цм�������ԭ�ӹ�ƽ�棬˵�����⻯���к���˫�����������⻯������ϩ�к��ЦҼ��ͦм�������1��2���⻯�����x��CԪ�أ�Z��L������2��δ�ɶԵ��ӣ���L������6�����ӣ�����ZΪOԪ�أ�Qԭ��s�ܼ���P�ܼ���������ȣ���Q�ĵ����Ų�Ϊ1s22s22p63s2������QΪMgԪ�أ�R������������ּ���������Ӳ�Ʒ �ĺ��IJ��ϣ���RΪSiԪ�أ�T�������ڱ���ds����ԭ����ֻ��һ��δ�ɶԵ��ӣ���TΪCuԪ�أ�X��Y��Z��G��Q��R��Tԭ��������������YΪNԪ�أ�G���γɷ��������ԭ������С��Mg����GΪNaԪ�أ�
��1��YΪNԪ�أ�������Ų�ͼΪ�� ��������ԭ�Ӻ����7�ֲ�ͬ�˶�״̬�ĵ��ӣ�Cuԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p63d104s1������Cuԭ����7�ֲ�ͬ�ܼ��ĵ��ӣ�
��������ԭ�Ӻ����7�ֲ�ͬ�˶�״̬�ĵ��ӣ�Cuԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p63d104s1������Cuԭ����7�ֲ�ͬ�ܼ��ĵ��ӣ�
�ʴ�Ϊ��7��7��
��2��C��N��OΪͬ����Ԫ�أ�ͬ����Ԫ�ص�һ�����ܴ��������������ǵ�IIA�����IIIA�巴������VA�����VIA�巴�������ԣ�C��N��O�ĵ�һ��������С�����˳��Ϊ��C��O��N���ʴ�Ϊ��C��O��N��
��3����֪CO2��CNO-Ϊ�ȵ����壬����ߵĿռ�ṹ�ͺ��ӻ���ʽ��ͬ����֪ΪCO2ֱ���Σ�CΪsp�ӻ�������CNO-��CΪsp�ӻ����ʴ�Ϊ��sp�ӻ���
��4����ͬ�����۵��һ������ǣ����Ӿ�����۵㣾���Ӿ�����۵㣬���Ӿ����а뾶ԽС���������Խ�࣬�۵�Խ�ߣ�NaF��MgF2Ϊ���Ӿ��壬SiF4Ϊ���Ӿ��壬��SiF4���۵�ͣ�Mg2+�İ뾶��Na+�İ뾶С��������ߣ�������MgF2��NaF����MgF2���۵��NaF�ߣ�
�ʴ�Ϊ��NaF��MgF2Ϊ���Ӿ��壬SiF4Ϊ���Ӿ��壬��SiF4���۵�ͣ�Mg2+�İ뾶��Na+�İ뾶С��������ߣ�������MgF2��NaF����MgF2���۵��NaF�ߣ�
��5����Cu����������Һ����μ��백ˮ����������ʼ����������ͭ���������������ܽ������İ���ͭ���ӣ��䷴Ӧ�����ӷ���ʽΪ��Cu2++2NH3•H2O=Cu��OH��2��+2NH4+��Cu��OH��2+4NH3=[Cu��NH3��4]2++2OH-��
�ʴ�Ϊ��Cu2++2NH3•H2O=Cu��OH��2��+2NH4+��Cu��OH��2+4NH3=[Cu��NH3��4]2++2OH-��
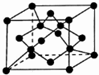
��6��C���ʵľ�����ͼ��ʾ���ڶ�����8��ԭ�ӣ�������2��ԭ�ӣ������ڲ�Ϊ4��ԭ�ӣ�����һ��C������ԭ����Ϊ��8��$\frac{1}{8}$+6��$\frac{1}{2}$+4=8���辧�������������Xԭ��֮��ľ���Ϊxcm�������ı߳�Ϊacm����a3=$\frac{\frac{12��8}{{N}_{A}}}{��}$���ɾ���ͼ��֪a2+a2=��4x•sin$\frac{109��28��}{2}$��2������2$\root{3}{\frac{12}{��{N}_{A}}}$=2$\sqrt{2}$x•sin$\frac{109��28��}{2}$��
����x=$\frac{\sqrt{2}��\root{3}{\frac{12}{��{N}_{A}}}}{2sin\frac{109��28��}{2}}$����$\frac{\sqrt{3}}{4}��\root{3}{\frac{96}{��{N}_{A}}}$����
�ʴ�Ϊ��8��$\frac{\sqrt{2}��\root{3}{\frac{12}{��{N}_{A}}}}{2sin\frac{109��28��}{2}}$����$\frac{\sqrt{3}}{4}��\root{3}{\frac{96}{��{N}_{A}}}$����
���� ���⿼����Ԫ�ص��ƶϣ��漰�˵��ӵ��˶�״̬���жϣ��縺�ԵıȽϣ������۷е�ıȽϣ����ӷ���ʽ����д���������йؼ��㣬�����֪ʶ��϶࣬��Ŀ�ѶȽϴ�


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3-CH=CH2��CH2=CH2�����ʽ��ͬ | |
| B�� | 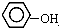 �� �� ��Ϊͬϵ�� ��Ϊͬϵ�� | |
| C�� | �������ʵķе㰴�ɵ͵���˳��Ϊ����CH3��2CHCH3����CH3��4C����CH3��2CHCH2CH3��CH3��CH2��3CH3 | |
| D�� | �������ļ��顢�Ҵ�����ȩ�ֱ���ȼ�գ������������������μ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ӵ�CaCO3���� | B�� | �Ӵ������Ũ�� | ||
| C�� | ��ʱ��������CO2���� | D�� | ��СCaCl2��Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
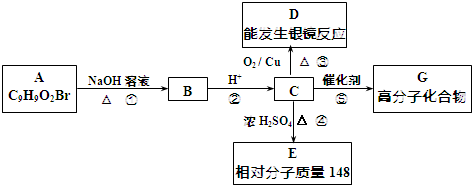
 ��
��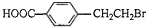 +2NaOH$��_{��}^{ˮ}$
+2NaOH$��_{��}^{ˮ}$ +NaBr+H2O��
+NaBr+H2O�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
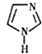 ����Һ�����л��ϳɡ����ϳɵȷ���������ҪӦ�ã������Ǻϳɡ�����Һ�塱��һ��ԭ�ϣ���ṹ��ͼ��ʾ�������й�����˵����ȷ���ǣ�������
����Һ�����л��ϳɡ����ϳɵȷ���������ҪӦ�ã������Ǻϳɡ�����Һ�塱��һ��ԭ�ϣ���ṹ��ͼ��ʾ�������й�����˵����ȷ���ǣ�������| A�� | ����ʽΪC3H3N2 | |
| B�� | �����к���һ�ַǼ��Լ������ּ��Լ� | |
| C�� | ���Է���ȡ�����ӳɡ�������Ӧ | |
| D�� | һ��ȡ�����ͬ���칹�干��5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ${\;}_{1}^{1}$H��${\;}_{1}^{3}$H | B�� | O2��O3 | C�� | ��������춡�� | D�� | ��ϩ�ͱ�ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ȶ��ԣ�NH3��PH3��AsH3 | B�� | ���Ӱ뾶�������ӣ������� | ||
| C�� | �۷е㣺���ӻ�������ۻ����� | D�� | ���ԣ�H2SO4��H3PO4��H2SiO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������A��ʾ�ķ�Ӧ����Ϊ0.4mol/��L•s�� | |
| B�� | ������B��ʾ�ķ�Ӧ����Ϊ0.4mol/��L•s�� | |
| C�� | 2 sʱ����B��ת����Ϊ40% | |
| D�� | 2 sʱ����C��Ũ��Ϊ1.2 mol/L |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com