
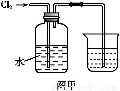
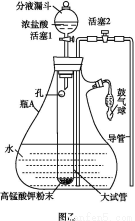
氯水是实验室常需临时配制的一种试剂。图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓入空气的仪器)。
(1)氯水需临时配制的原因是 (用化学方程式表示)。
(2)图甲所示装置中,烧杯内的液体是 。
(3)用图乙所示装置中配制氯水时,操作步骤如下:
①关闭活塞2 ,打开分液漏斗上口的玻璃塞,再打开活塞1 ,将少量浓盐酸注入大试管内。
②关闭活塞1 ,盖上分液漏斗上口玻璃塞。浓盐酸和大试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A ,使氯气不断溶入水中。用图乙装置能在较短时间内得到饱和氯水。除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是 。
分液漏斗中的浓盐酸应分数次加入试管内。若一次加入太多的浓盐酸,可能引起的后果是 。
(4)配制氯水完成后,不必拆卸装置即可从瓶A 中取用少量氯水,方法是 。
(1)2HClO 2HCl+O2↑
2HCl+O2↑
(2)NaOH溶液
(3)氯气在瓶内产生较大压强,增大了氯气的溶解度 瓶内产生过多的氯气,瓶内压强过大会使瓶A的橡皮塞弹开
(4)打开活塞2,关闭活塞1,用鼓气球向瓶A中鼓入空气
【解析】(1)氯水中的次氯酸在光照、受热条件下会分解,所以氯水需临时配制。
(2)图甲是把氯气通过水来制取氯水,烧杯内应该盛装能够吸收氯气的NaOH溶液。
(3)在大试管中注入浓盐酸后,生成的氯气通过大试管上的小孔进入瓶A内与水反应,此时瓶A组成一个密闭装置,压强增大利于氯气的溶解。如果加入浓盐酸过多,反应过于剧烈,瓶A内压强过大,就可能使瓶口的橡皮塞弹开。
(4)取用氯水时可以打开活塞2,通过鼓气球向瓶内鼓入空气,瓶内气体压强增大,氯水就会通过导管流出。


科目:高中化学 来源:2014高考化学名师选择题专练 实验基础练习卷(解析版) 题型:选择题
在实验室进行下列实验, 括号内的实验用品都能用到的是( )
A.硫酸铜晶体里结晶水含量的测定(坩埚、温度计、硫酸铜晶体)
B.蛋白质的盐析(试管、醋酸铅溶液、鸡蛋白溶液)
C.钠的焰色反应(铂丝、氯化钠溶液、稀盐酸)
D.肥皂的制取(蒸发皿、玻璃棒、甘油)
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 NA的应用练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
B.在熔融状态下,1 mol NaHSO4完全电离出的阳离子数为2NA
C.78 g Na2O2固体与H2O完全反应转移的电子数为NA
D.5.6 g铁粉在2.24 L(标准状况)氯气中充分燃烧,失去的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 物质性质综合应用练习卷(解析版) 题型:填空题
以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种。近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐:4CuFeS2+2H2SO4+17O2 4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:
4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:
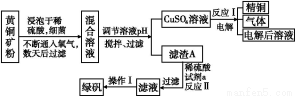
回答下列问题:
(1)下列物质中可以用于上述流程中调节溶液pH的是 (填序号)。
A.Cu;B.Cu2(OH)2CO3;C.H2SO4;D.Fe;E.CuO
(2)滤渣A的主要成分为 (写化学式)。
(3)写出反应Ⅰ的化学方程式: 。
(4)试剂a为 。
(5)欲从溶液中获得绿矾晶体,分离操作Ⅰ应为 (写操作名称)。
(6)生产过程中,除了试剂a、H2O可以循环使用外,还可循环使用的物质有 (写化学式)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 有机合成与推断练习卷(解析版) 题型:填空题
有机物D是一种合成抗高血压药的重要通用中间体,其合成路线如下:(已知A是一种芳香酸)
A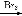

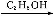 C
C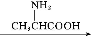
(1)A、C的结构简式分别是 、 ,D中含有的含氧官能团名称是 。
(2)C→D的反应类型是 。
(3)加热条件下,C在足量NaOH水溶液中反应的化学方程式是 。
(4)E是一种相对分子质量比A小14的芳香酸。写出满足下列条件的E的所有同分异构体的结构简式: 。
①能发生银镜反应
②一定条件下可发生水解反应
③分子的核磁共振氢谱中有四组峰
(5)F是B在碱溶液中水解后再酸化的产物。F在一定条件下可聚合成高分子化合物,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学反应原理练习卷(解析版) 题型:填空题
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)如图是在101 kPa、298 K条件下1 mol NO2和1 mol CO反应生成1 mol CO2和1 mol NO过程中能量变化示意图。
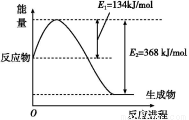
已知:N2(g)+O2(g)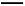 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
2NO(g)+O2(g)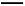 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
则在298 K时,反应:2NO(g)+2CO(g)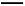 N2(g)+2CO2(g)的ΔH= 。
N2(g)+2CO2(g)的ΔH= 。
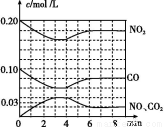
(2)将0.20 mol NO2和0.10 mol CO 充入一个容积恒定为1 L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。
①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K值增大
c.升高温度后,K值减小,NO2的转化率减小
d.向该容器内充入He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO2在0~2 min时平均反应速率v(NO2)= mol/(L·min)。
③第4 min时改变的反应条件为 (填“升温”或“降温”)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充入CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。
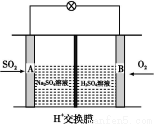
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极的反应式为 ,当有0.25 mol SO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 。
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。现将2×10-4 mol/L的Na2CO3溶液与一定浓度的CaCl2溶液等体积混合生成沉淀,计算应加入CaCl2溶液的最小浓度为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修3物质结构与性质练习卷(解析版) 题型:填空题
Ⅰ.金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子的价电子(外围电子)排布式为 。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2 CH2、②HC≡CH、③
CH2、②HC≡CH、③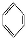 、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。
、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。
(4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”)。
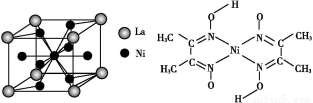
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 。
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如右下图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修2化学与技术练习卷(解析版) 题型:选择题
金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法不正确的是( )
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是用电解熔融氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题7元素周期表与元素周期律练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com