
| A. | 油脂、糖类和蛋白质是三大营养物质,都能发生水解;被称作“人体核武器”的维生素B2含有肽键结构等,也能发生水解 | |
| B. | 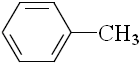 、 、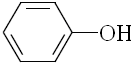 和 和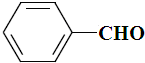 ,仅第一种能使KMnO4酸性溶液褪色 ,仅第一种能使KMnO4酸性溶液褪色 | |
| C. | 氨基酸主要以内盐形式存在,调节溶液的pH不可改变它在水中的溶解度 | |
| D. | 体检报告单中的“甘油三酯”是甘油的衍生物,其中甘油结构简式是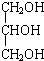 |
分析 A.糖类中单糖不能水解,油脂中含COOC-,蛋白质、维生素B2含有肽键结构;
B.三种物质均可被高锰酸钾氧化;
C.氨基酸-NH2、-COOH个数可能不同,酸碱性不同;
D.甘油为丙三醇.
解答 解:A.单糖不能水解,而油脂中含COOC-,蛋白质、维生素B2含有肽键结构,可发生水解反应,故A错误;
B.KMnO4是强氧化剂,三者均能被它氧化而褪色,故B错误;
C.由于氨基酸-NH2、-COOH个数可能不同,电离程度也可能不同,酸碱性有差异,调节pH可能使其在水中的溶解度发生变化,故C错误;
D.“甘油三酯”是甘油的衍生物,其中甘油为丙三醇,其结构简式是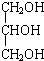 ,故D正确;
,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物中官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,选项C为解答的难点,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | CH3CH2CH2CH2CH2OH | B. | 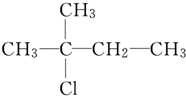 | ||
| C. | 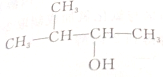 | D. | 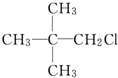 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
 ,
, G元素的最高价氧化物电子式
G元素的最高价氧化物电子式
 ;H的氢化物的电子式
;H的氢化物的电子式
| 元素 | 实验设计 | 现象 | 结论 |
| B | 分别在两个盛有滴加酚酞的水的烧杯中加入形状相同的Na和K,观察现象 | K在反应中伴随轻微爆炸,钾比钠的反应更剧烈 | 金属性: K>Na |
| F |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
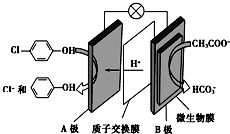 含乙酸钠和对氯酚(
含乙酸钠和对氯酚(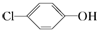 )的废水可以利用微生物电池除去,其原理如图所示:下列有关说法不正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示:下列有关说法不正确的是( )| A. | 电极B是负极 | |
| B. | 质子从A极移向B极 | |
| C. | B极的电极反应式:CH3COO--8e-+2H2O=2CO2+7H+ | |
| D. | 处理后的废水pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +43.5 | B. | -43.5 | ||
| C. | -67.7 | D. | +67.7(单位:kJ•mol-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 234U,235U,238U是不同的核素,互称同位素 | |
| B. | 陶瓷,玻璃,水晶,红宝石都属于硅酸盐 | |
| C. | Na与熔融的KCl反应能制取K,但不能证明Na的金属性比K强 | |
| D. | 在400℃,800个大气压下,钠能与二氧化碳生成钻石和石墨,反应过程中CO2被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向烧碱溶液中加入铝:Al+2OH-=AlO2-+H2↑ | |
| B. | 用过量氨水吸收烟道气中的SO2:SO2+2NH3•H2O=SO32-+2NH4++H2O | |
| C. | 将饱和FeCl3溶液滴入废水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ | |
| D. | 用Fe2+将饮用水中少量ClO2-还原成为Cl-:4Fe2++ClO2-+4H+=4Fe3++Cl-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com