
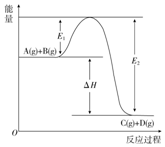
 反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题.分析 (1)根据反应物与生成物总能量大小判断;
(2)由图象可知E1表示反应物断键吸收的总能量,E2表示生成物形成放出的总能量,△H=反应物断键吸收的总能量-生成物形成放出的总能量;
(3)加入催化剂能降低反应的活化能,催化剂不改变反应物总能量与生成物总能量之差即反应热不变;
(4)加入催化剂能降低反应的活化能.
解答 解:(1)由图象可知该反应是一个能量降低的反应,所以属于放热反应;故答案为:放热;
(2)由图象可知E1表示反应物断键吸收的总能量,E2表示生成物形成放出的总能量,△H=反应物断键吸收的总能量-生成物形成放出的总能量=E1-E2;
故答案为:反应物断键吸收的总能量;生成物形成放出的总能量;E1-E2;
(3)加入催化剂改变了反应的途径,降低反应所需的活化能,但反应热取决于反应物总能量与生成物总能量之差,与催化剂的使用无关,所以加入催化剂对反应热无影响,故答案为:无影响,因为反应热取决于反应物总能量与生成物总能量的差值,与催化剂无关;
(4)加入催化剂能降低反应的活化能,所以E1和E2均减小;故答案为:减小;减小.
点评 本题考查反应热的判断,影响反应热和平衡的因素,难度适中,注意催化剂对活化能和反应热的影响.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温、同压下,相同质量的气体都占有相同的体积 | |
| B. | 同温、同压下,相同体积的气体都含有相同数目的原子 | |
| C. | 在任何情况下,1 mol CO2和64 g SO2所含有分子数和原子总数都相同 | |
| D. | 1 mol某气体的体积约为22.4 L,该气体所处的状况一定是标准状况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g H2O在标准状况下的体积是22.4L | |
| B. | 常温常压下,4g H2含有的分子数为 2NA | |
| C. | 2.3g金属钠变为钠离子时失去的电子数为NA | |
| D. | 17g氨气所含原子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
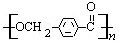 的路线:
的路线: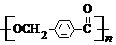
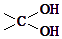 →
→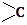 ═O+H2O
═O+H2O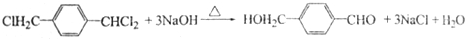 ;该反应过程中生成的不稳定中间体的结构简式应是
;该反应过程中生成的不稳定中间体的结构简式应是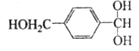 .
.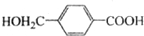 ,D的同分异构体中含有苯环且水解产物之一为乙酸的有3种,写出其中的一种结构简式:
,D的同分异构体中含有苯环且水解产物之一为乙酸的有3种,写出其中的一种结构简式: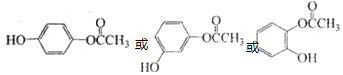 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 跟水反应时,水作氧化剂 | B. | NaH在水中显酸性 | ||
| C. | 跟液氨反应时,有NaNH2生成 | D. | 跟乙醇反应时,NaH被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打溶液和NaAlO2溶液反应可以产生沉淀和气体,可以用作泡沫灭火器成分 | |
| B. | 侯德榜制碱过程涉及溶解度差异的原理,工业上从铝土矿制备较高纯度Al2O3的主要工艺流程中使用到CO2气体 | |
| C. | 一定条件下,Na、Mg、Fe都能和水反应生成对应的碱和氢气,Na2O2、MgO、Fe3O4都是碱性氧化物 | |
| D. | 纳米Fe、纳米Cu的化学活性都比原来增强,两者都能与盐酸反应生成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
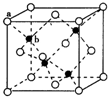 E、G、M、Q、T是五种原子序数依次增大的前四周期元素E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与QM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与QM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: (若有配位键,请用“→”表示),E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性;
(若有配位键,请用“→”表示),E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性; 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com