
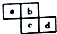
| A. | 原子半径:c>d>a>b | |
| B. | 原子序数d可能是a的3倍 | |
| C. | 最高价含氧酸的酸性c可能比d强 | |
| D. | 四种元素的氢化物可能是18电子分子 |
分析 这几种元素都是短周期主族元素,a、b位于第二周期而c、d位于第三周期,
A.原子核外电子层数越多,其原子半径越大;同一周期元素,原子半径随着原子序数增大而减小;
B.假设a的原子序数是x,则d的原子序数=x+10,如果d的原子序数是a的3倍,则3x=x+10,x=5,则a是B、d是P元素;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.如果a、b、c、d分别是N、O、S、Cl元素,其形成的18电子氢化物分别为N2H4、H2O2、H2S、HCl.
解答 解:这几种元素都是短周期主族元素,a、b位于第二周期而c、d位于第三周期,
A.原子核外电子层数越多,其原子半径越大;同一周期元素,原子半径随着原子序数增大而减小,所以这几种原子半径大小顺序是c>d>a>b,故A正确;
B.假设a的原子序数是x,则d的原子序数=x+10,如果d的原子序数是a的3倍,则3x=x+10,x=5,则a是B、d是P元素,所以原子序数d可能是a的3倍,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性c>d,所以最高价含氧酸的酸性c一定比d强,故C错误;
D.如果a、b、c、d分别是N、O、S、Cl元素,其形成的18电子氢化物分别为N2H4、H2O2、H2S、HCl,所以四种元素的氢化物可能是18电子分子,故D正确;
故选C.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析推断及发散思维能力,明确原子结构、元素周期表结构及元素周期律是解本题关键,熟记10电子、18电子微粒,题目难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
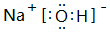 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 酚类-OH
酚类-OH 羧酸-COOH--
羧酸-COOH-- 醛类
醛类

 酯类
酯类
| A. | (1)(2)(3)(4)(5) | B. | (2)(4) | C. | (2)(3)(4) | D. | (2)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

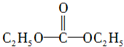 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
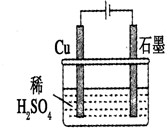
| A. | 石墨是电解池的负极,Cu是电解池的正极 | |
| B. | 电解过程中,铜电极上自身没什么变化 | |
| C. | 电解一定时间后,石墨电极上会有铜析出 | |
| D. | 整个电解过程中,溶液的pH不会变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ②HNO3 | ③NaOH ④KOH | ⑤Na2SO4 ⑥K2SO4,KNO3 | ⑦SO2 ⑧SO3 | ⑨NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com