
| A. | Na2CO3 NaHCO3 NaCl NH4Cl | |
| B. | Na2CO3 NaHCO3 NH4Cl NaCl | |
| C. | (NH4)2SO4 NH4Cl NaNO3 Na2CO3 | |
| D. | (NH4)2SO4 NH4Cl NaNO3 Na2S |
分析 pH由小到大的顺序为:酸性<中性<碱性,结合盐的水解判断溶液的pH,以此来解答.
解答 解:A.Na2CO3、NaHCO3水解显碱性,且Na2CO3水解程度大,NaCl不水解,NH4Cl水解显酸性,则Na2CO3、NaHCO3、NaCl、NH4Cl的pH由大到小,故A不选;
B.Na2CO3、NaHCO3、NH4Cl、NaCl中,NH4Cl水解显酸性,其pH最小,故B不选;
C.NH4Cl、(NH4)2SO4水解显酸性,且(NH4)2SO4水解生成氢离子浓度大,NaNO3不水解,Na2CO3水解显碱性,则pH由小到大的顺序为(NH4)2SO4、NH4Cl、NaNO3、Na2CO3,故C选;
D.NH4Cl、(NH4)2SO4水解显酸性,且(NH4)2SO4水解生成氢离子浓度大,NaNO3不水解,Na2S水解显碱性,则pH由小到大的顺序为(NH4)2SO4、NH4Cl、NaNO3、Na2S,故D选;
故选CD.
点评 本题考查盐类水解及pH比较,为高频考点,把握盐类水解规律及酸碱性判断为解答的关键,侧重分析与应用能力的考查,注意氢离子浓度越大时pH越小,题目难度中等.


科目:高中化学 来源: 题型:选择题
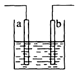
| A. | a、b可能是同种材料的电极 | |
| B. | 该装置可能是电解池,电解质溶液为稀硫酸 | |
| C. | 该装置可能是Cu-Ag原电池,电解质溶液为稀硝酸 | |
| D. | 该装置中通过2 mol电子时,溶液质量增加62g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1的NaHCO3溶液中:c (Na+ )>c(HCO3-)>c (OH-)>c (H+ ) | |
| B. | 叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c (Na+ )>c(N3-)>c (OH-)>c (H+ ) | |
| C. | 常温下向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 常温下,等pH的CH3COONa、NaHCO3、NaClO三种溶液的浓度大小关系为c (NaClO)>c (NaHCO3)>c (CH3COONa) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胆矾的形状改变,质量不变 | B. | 体系中不再发生溶解过程 | ||
| C. | 溶液质量减小,浓度不变 | D. | 溶液中溶剂质量增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 英国道尔顿----提出元素概念 | |
| B. | 法国拉瓦锡----提出原子学说 | |
| C. | 汤姆生---发现电子 | |
| D. | 英国波义耳----建立燃烧现象的氧化学说 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉溶于稀盐酸:2Fe+6H+═2Fe3++3H2 | |
| B. | 碳酸钙溶于稀盐酸中:CO32-+2H+═CO2+H2O | |
| C. | 氧化铜溶于醋酸:CuO+2CH3COOH═Cu2++2CH3COO-+H2O | |
| D. | 硫酸铜与氢氧化钡溶液混合:Ba2++SO42-═BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定温度下AgCl水溶液中,Ag+和Cl- 浓度的乘积是一个常数 | |
| B. | AgCl的Ksp=1.8×10-10,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl- )且Ag+与Cl-浓度的乘积等于1.8×10-10 | |
| C. | 在一定温度下,向饱和AgCl水溶液中加入盐酸,Ksp值变大 | |
| D. | 在一定温度下,当溶液中Ag+和Cl- 浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com