
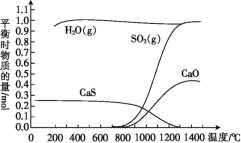
【题目】氢气还原石膏的过程会发生多个反应,其中主要反应为Ⅰ、Ⅱ、Ⅲ,当CaSO4(s)与H2(g)的起始物质的量之比为1∶1时,测得平衡时物质的量如图所示。
Ⅰ:CaSO4(s)+H2(g)![]() CaO(s)+H2O(g)+SO2(g) ΔH1>0
CaO(s)+H2O(g)+SO2(g) ΔH1>0
Ⅱ:CaSO4(s)+4H2(g)![]() CaS(s)+4H2O(g) ΔH2<0
CaS(s)+4H2O(g) ΔH2<0
Ⅲ:3CaSO4(s)+CaS(s)![]() 4CaO(s)+4SO2(g) ΔH3
4CaO(s)+4SO2(g) ΔH3
回答下列问题:
(1)100 ℃~700 ℃主要发生反应____(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)ΔH3=____(用含ΔH1、ΔH2的代数式表示),ΔH3____(填“>”或“<”)0,反应Ⅲ达到平衡后,升高温度,平衡____(填“正向”或“逆向”)移动。
(3)向某恒温恒容密闭容器中加入0.3 mol CaSO4和0.1 mol CaS,高温下若只发生反应Ⅲ,达到平衡时向容器中再充入少量SO2,下列说法正确的是____(填字母)。
A.重新平衡时,容器内气体总压强增大
B.重新平衡时,CaO的量减少
C.重新平衡时,SO2的浓度不变
D.CaSO4(s)、CaS(s)的质量不变
(4)其他条件一定时,H2的流量与石膏的分解率和脱硫率关系如图所示。在气体流量高于242 mL·min-1时,分解率和脱硫率均降低,可能的原因是____(只写一条)。

(5)已知其中副反应之一为2CaSO4(s)![]() 2CaO(s)+2SO2(g)+O2(g),在1625 K时,平衡常数Kp=1.45×10-5 atm3(atm表示大气压,
2CaO(s)+2SO2(g)+O2(g),在1625 K时,平衡常数Kp=1.45×10-5 atm3(atm表示大气压,![]() ≈3.81)。该温度下,反应CaO(s)+SO2(g)+
≈3.81)。该温度下,反应CaO(s)+SO2(g)+![]() O2(g)
O2(g) ![]() CaSO4(s)的K'p=____(保留整数部分)。
CaSO4(s)的K'p=____(保留整数部分)。
【答案】Ⅱ 4ΔH1-ΔH2 > 正向 BC 生成的SO2在过量H2的作用下又重新生成CaS或CaSO4 262
【解析】
(1)由图可知,100 ℃~700 ℃反应达到平衡时,水蒸气和硫化钙的物质的量比为1.0mol:0.25mol=4:1;
(2)由盖斯定律可知,Ⅰ×4—Ⅱ=Ⅲ,则ΔH3=4ΔH1-ΔH2;由图可知,升高温度,生成物二氧化硫和氧化钙的物质的量增大,说明平衡向正反应方向移动;
(3)由化学方程式可知,反应Ⅲ的化学平衡常数K=c4(SO2),温度不变,平衡常数不变,则达到平衡时向容器中再充入少量SO2,平衡向逆反应方向移动,重新平衡时,容器内二氧化硫的浓度和物质的量不变,CaSO4(s)的质量增大,CaS(s)的质量减小;
(4)在氢气流量高于242 mL·min-1时,导致氢气过量,反应生成的二氧化硫在过量氢气的作用下重新生成硫化钙和硫酸钙;
(5)反应CaO(s)+SO2(g)+![]() O2(g)
O2(g) ![]() CaSO4(s)的K'p=
CaSO4(s)的K'p=![]() 。
。
(1)由图可知,100 ℃~700 ℃反应达到平衡时,水蒸气和硫化钙的物质的量比为1.0mol:0.25mol=4:1,由题给化学方程式的化学计量数可知,主要发生反应Ⅱ,故答案为:Ⅱ;
(2)由盖斯定律可知,Ⅰ×4—Ⅱ=Ⅲ,则ΔH3=4ΔH1-ΔH2;由图可知,升高温度,生成物二氧化硫和氧化钙的物质的量增大,说明平衡向正反应方向移动,该反应为吸热反应,故答案为:4ΔH1-ΔH2;>;正向;
(3)A.由化学方程式可知,反应Ⅲ的化学平衡常数K=c4(SO2),温度不变,平衡常数不变,则达到平衡时向容器中再充入少量SO2,重新平衡时,容器内二氧化硫的浓度和物质的量不变,气体总压强不变,故错误;
B. 达到平衡时向容器中再充入少量SO2,生成物浓度增大,平衡向逆反应方向移动,重新平衡时,CaO的量减少,故正确;
C. 由化学方程式可知,反应Ⅲ的化学平衡常数K=c4(SO2),温度不变,平衡常数不变,则达到平衡时向容器中再充入少量SO2,重新平衡时,容器内二氧化硫的浓度和物质的量不变,故正确;
D. 达到平衡时向容器中再充入少量SO2,生成物浓度增大,平衡向逆反应方向移动,重新平衡时,CaSO4(s)的质量增大,CaS(s)的质量减小,故错误;
BC正确,故答案为:BC;
(4)在氢气流量高于242 mL·min-1时,导致氢气过量,反应生成的二氧化硫在过量氢气的作用下重新生成硫化钙和硫酸钙,导致分解率和脱硫率均降低,故答案为:生成的SO2在过量H2的作用下又重新生成CaS或CaSO4;
(5)反应CaO(s)+SO2(g)+![]() O2(g)
O2(g) ![]() CaSO4(s)的K'p=
CaSO4(s)的K'p=![]() =
=![]() =
=![]() ≈262,故答案为:262。
≈262,故答案为:262。


科目:高中化学 来源: 题型:
【题目】烧杯A中盛放0.1mol/L的H2SO4溶液,烧杯B中盛放0.1mol/L的的CuCl2溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是( )
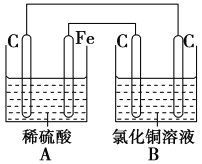
A.A为原电池,B为电解池
B.A为电解池,B为原电池
C.当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
D.经过一段时间,B烧杯中溶液的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质检验的实验结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 某溶液中加入氯化钡溶液 | 生成白色沉淀 | 该溶液一定含有SO42- |
B | 某溶液中加入无色酚酞试液 | 溶液变红色 | 该溶液一定是碱溶液 |
C | 将某溶液做焰色反应 | 焰色呈黄色 | 该溶液一定含有Na+ |
D | 往某溶液中加入盐酸 | 产生无色气体 | 该溶液一定含有CO32- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇燃料电池采用硫酸作为电解质溶液,是一种可再生清洁的电池,电池的示意图如图,电池总反应式为C2H5OH+3O2=2CO2+3H2O。
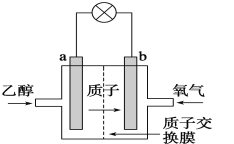
(1)a是___极(选“正”或“负”),发生___反应;电流由___极流向___极(选“a”或“b”),SO42-移向___极(选“a”或“b”)。
(2)随着电池的不断放电,硫酸溶液的物质的量浓度将___。(选“变大”或“不变”或“变小”)
(3)电池的负极电极反应式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.1 mol·L-1NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数δ[δ(X)=![]() ]如图所示:
]如图所示:
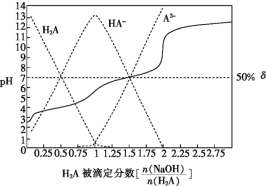
下列说法错误的是
A.用NaOH溶液滴定0.1 mol·L-1NaHA溶液可用酚酞作指示剂
B.0.1 mol·L-1Na2A溶液中:c(Na+)<c(HA-)+2c(A2-)
C.0.1 mol·L-1NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
D.H2A 的Ka2=1×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)基态Co2+的核外电子排布式为____。
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1 mol Fe(CO)5含有____mol配位键,图2中C原子的杂化方式为____,形成上述两种化合物的四种元素中电负性最大的是____(填元素符号)。
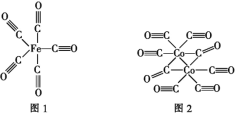
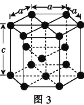
(3)金属钴的堆积方式为六方最密堆积,其配位数是____,钴晶体晶胞结构如图3所示,该晶胞中原子个数为____;该晶胞的边长为a nm,高为c nm,该晶胞的密度为____(NA表示阿伏加德罗常数的值,列出代数式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列原子或原子团,请按要求选择两个,写出符合要求的有机物的结构简式:﹣CH3、﹣OH、﹣CHO、﹣COOH、﹣Br、﹣H、﹣CH2CH3、![]()
(l)分子结构为正四面体的是:___;
(2)能使FeCl3溶液显紫色的是:___;
(3)在NaOH乙醇溶液中能发生消去反应的是:____;
(4)1mol该有机物与足量的银氨溶液反应,有4molAg生成的是:___;
(5)相对分子质量是60,能和NaHCO3反应放出CO2的是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如右图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。请回答下列问题:
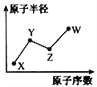
(1)写出四种元素的元素符号:X____ Y____ Z____ W____
(2)HYO3的酸性比HWO强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确___,说明理由__________________________________。
(3)甲和乙分别是由W、X、Y、Z四种元素中的三种元素组成的常见化合物,化合物甲具有漂白消毒杀菌作用,其化学式为________;化合物乙是一种常见的强酸,会因保存不当而变成黄色液体,其原因是_______________________________。把红热的木炭投入黄色液体,剧烈反应,方程式为_____________________,将产生的气体通过澄清石灰水时气体变为无色,但未见有浑浊现象,原因是______________。(写出有关反应的化学方程式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中的没食子儿茶素(EGC)结构如图所示.关于EGC的下列叙述中正确的是( )

A.EGC的分子式为C15H14O5,属于芳香烃类化合物
B.1molEGC与4molNaOH恰好完全反应
C.该物质能够发生取代反应、加成反应、氧化反应、还原反应、显色反应
D.分子中所有的原子处在同一个平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com