
(1)请完成该反应的离子方程式:
C + MnO4- + H+ — CO2↑+ Mn2+ + H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应CO(g ) + H2O(g)  CO2(g) + H2(g)得到如下两组数据:
CO2(g) + H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
 pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(1)①5 C + 4 MnO4- + 12 H+ = 5 CO2↑+ 4 Mn2+ + 6 H2O
(2)①0.13 mol·L-1 ·min-1; ②放 ; 20%
(3)①不; ②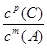 .
.
(4)4×10-11
解析试题分析:(1)①反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,C→CO2,碳元素化合价由0价升高为+4,共升高4价,化合价最小公倍数为20,故MnO4-系数为4,C系数为5,再根据元素守恒可知Mn2+系数为4、CO2系数为5,根据电荷守恒可知H+系数为12,根据氢元素守恒可知H2O系数为6,配平后离子方程式为5 C + 4 MnO4- + 12 H+ ="=" 5 CO2↑+ 4 Mn2+ + 6 H2O,答案:5 C + 4 MnO4- + 12 H+ ="=" 5 CO2↑+ 4 Mn2+ + 6 H2O。
(2)①、由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,v(CO)= ,速率之比等于化学计量数之比,故v(CO2)=v(CO)=
,速率之比等于化学计量数之比,故v(CO2)=v(CO)=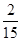 mol/(L·min)=0.13mol/(L·min),
mol/(L·min)=0.13mol/(L·min),
故答案为:0.13mol/(L·min);
②、实验1中CO的转化率为×100%=40%,实验2中CO的转化率为×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,
故答案为:放热;
平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g) CO2(g)+H2(g),
CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
实验2中达平衡时 CO的转化率为 ×100%=20%
×100%=20%
答案:①0.13 mol·L-1 ·min-1; ② 放 ; 20%
(3) ①压强从2×105Pa增加到5×105 Pa时,A的浓度应变化为0.08mol·L-1的2.5倍即为0.20mol·L-1,而图表中变化为0.20mol·L-1,说明平衡不移动,加压时生成物A浓度增大的倍数等于压强增大的倍数;
②压强从2×105 Pa 增加到1×106 Pa时,A的浓度应变化为0.08mol·L-1的5倍即0.40mol·L-1,而图表中A的浓度为0.44mol·L-1,说明平衡逆向进行;根据①可知反应是气体体积增大的反应,所以此时B加压变为液体或固体,当压强从5×105 Pa增加到1×106 Pa时,该反应平衡常数表达式为K=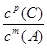
故答案为:①不; ② 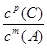 .
.
(4 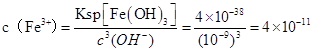 ,答案:4×10-11
,答案:4×10-11
考点:氧化还原反应方程式的配平;氧化还原反应的计算,化学平衡的影响因素;化学平衡的计算


科目:高中化学 来源: 题型:填空题
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为: ①取少量废液,滴加KSCN溶液显红色.②取10mL废液,加入足量的AgNO3溶液,析出沉淀8.61g.③另取10mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了0.256g,再向反应后的溶液中滴加KSCN溶液不变色.根据探究实验得出结论:
(1)废液中含有的金属离子是 。
(2)求10mL废液中氯离子的物质的量浓度?
(3)求10mL废液中铜离子的物质的量是 ?
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中, 是氧化剂, 是还原剂, 元素被氧化, 元素被还原,若0.3mol氯气生成则若0.3mol氯气生成转移的电子数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取,反应原理如下:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)若制得标准状况下11.2 L Cl2,则被氧化的HCl为___________mol。
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为__________。
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示: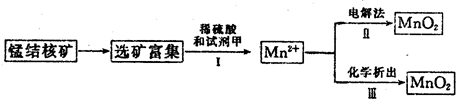
①步骤Ⅰ中, 试剂甲必须具有的性质是____________(填序号)。
A.氧化性B.还原性C.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL,该反应的离子方程式为___________________________。
(4)用100mL12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30 mol,请你分析可能的原因为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知硫氰(SCN)2为拟卤素,其分子及阴离子的性质与卤素性质相似。完成下列填空:将硫氰化钾溶液与氯化铁溶液混合,溶液变为血红色。
(1)写出该反应的化学方程式 。
将生成的血红色溶液分为四等份,进行如下实验(第四份是对照):
(2)第一份中加入少量的氯化钾固体,溶液的颜色 (填“会”或“不会”)加深。
(3)第二份中滴加入碘化钾溶液至过量,再加入四氯化碳,充分振荡,最终水层接近无色,四氯化碳层呈 色,写出该过程的离子方程式
。
向该溶液中滴加少量溴水,水溶液又变为血红色,则氧化性Br2 (SCN)2(填“大于”、“小于”或“无法确定”)。
(4)第三份中加入少量酸性高锰酸钾溶液,血红色褪去。完成并配平该反应的离子方程式。若含 mol高锰酸钾的溶液完全反应,转移电子2mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业上通过煅烧铬铁矿制取,其反应如下:
反应Ⅰ 4Fe(CrO2)2+8Na2CO3+7O2 → 2Fe2O3+8Na2CrO4+8CO2
反应Ⅱ 2CrO42- + 2H+ → Cr2O72- + H2O
反应Ⅲ 3CrO42- + 4H+ →Cr3O102- + 2H2O(副反应)
(1)上述反应中不属于氧化还原反应有 个。已知Fe(CrO2)2中铬元素是+3价,关于反应Ⅰ的下列说法中正确的是 。
a.被氧化的元素只有+3的Cr,被还原的元素只有0价的O
b.氧化剂与还原剂的物质的量之比为4:7
c.每生成1molCO2,转移3.5mol电子
d.每摩尔+3的Cr能还原0.75mol氧气
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O72-,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式并标出电子转移的方向和数目: 。
(3)某厂废水中含1.00×10?3mol/L的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2)。欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入 g FeSO4·7H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:
I.(1)现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为 。 (2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
| 起始浓度( mol/L) | C(NH3) | C(O2) | C(NO) | C(H2O) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 4 | 8 | 0 | 0 |
| 丙 | 0.2 | x | y | z |
 N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_ a2。
N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_ a2。查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(10分)(1)向用氯化铁溶液刻制印刷电路后的废液中,加入足量铁粉,发生反应的离子方程式是 、 。
(2)实验室向某溶液中加入硫氰化钾溶液,无现象,滴加少量氯水,立即变为红色,则原溶液中含有(填离子符号) ,写出滴加氯水时发生反应的离子方程式 。
(3)我们知道,浓硫酸有脱水性、吸水性和氧化性,请写出证明浓硫酸具有氧化性的反应的化学方程式(写一个,多写若有一个错误,本题不得分) 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学小组在学习元素周期律知识后,对教材中Cl2将Fe2+氧化成Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化成Fe3+,那么Br2和I2能否将Fe2+氧化成Fe3+?
环节一:理论推测。
部分同学认为Br2和I2都能将Fe2+氧化成Fe3+,依据是
____________________________________________。
部分同学认为Br2和I2都不能将Fe2+氧化成Fe3+。还有同学认为Br2能将
Fe2+氧化成Fe3+,而I2不能,依据是同一主族从上到下卤素单质的氧化性逐渐减弱。
环节二:设计实验进行验证。
向大试管中加入适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
| 操作 | 现象 |
| | |
| 操作 | 现象 |
| 向试管②所得的溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间。取出上层溶液,滴加KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;取上层溶液滴加KSCN溶液后,溶液呈浅红色 |
| 操作 | 现象 |
| 向另一支试管中加入2 mL新制的FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间。取出下层溶液,滴加KSCN溶液 | 静置后,上层溶液为紫色,下层溶液几乎无色;取下层溶液,向其中滴加KSCN溶液后,溶液没有呈浅红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com