
����Ŀ��ԭ������С��36��X��Y��Z��W����Ԫ�أ�����X�������к�������Ԫ�أ�Yԭ�ӻ�̬ʱ���������������ڲ��������2����Zԭ�ӻ�̬ʱ2pԭ�ӹ������3��δ�ɶԵĵ��ӣ�W��+1�������ӵĺ�����3�����Ӳ��Ҹ����������
�ش��������⣺
��1��W+�ļ۵����Ų�ʽΪ ��
��2��Y2X2������Yԭ�ӹ�����ӻ�����Ϊ ��1mol Y2X2������������ĿΪ ��
��3��������ZX3�ķе�Ȼ�����YX4�ĸߣ�����Ҫԭ���� ��
��4��Ԫ��Y��һ����������Ԫ��Z��һ�������ﻥΪ�ȵ����壬Ԫ��Z������������ķ���ʽ�� ��
��5��Ԫ��W��һ���Ȼ��ᄃ��ľ����ṹ��ͼ��ʾ�����Ȼ���Ļ�ѧʽ�� ��������Ũ���ᷢ����������ԭ��Ӧ�����������H2WCl3����Ӧ�Ļ�ѧ����ʽΪ ���ھ����������2��ԭ�Ӿ�����apm���������ܶ���_____________g��cm-3(ֻҪ������ʽ�����ؼ������ֵ������٤������ΪNA)��
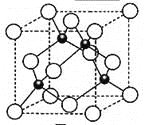
���𰸡���1��3d10
��2��sp�ӻ���3NA��3��6.02��1023��(2��)
��3��NH3���Ӽ�������
��4��N2O(2��)
��5��CuCl ��CuCI+2HCI = H2CuCl3 (��CuCl+2HCl = H2[CuCl3]��![]()
�����������������ԭ������С��36��X��Y��Z��W����Ԫ�أ�����X�������к�������Ԫ�أ���XΪHԪ�أ�Yԭ�ӻ�̬ʱ���������������ڲ��������2��������������������8�������ڲ������ֻ����2������������Ϊ4����Y��CԪ�أ�Zԭ�ӻ�̬ʱ2pԭ�ӹ������3��δ�ɶԵ��ӣ���Xԭ�Ӻ�������Ų�Ϊ1s22s22p6����ZΪNԪ�أ�W��+1�������ӵĺ�����3�����Ӳ��Ҹ����������ԭ�Ӻ��������Ϊ2+8+18+1=29����WΪCu��
��1��Cu+�ļ۵����Ų�ʽΪ��3d10��
��2��C2H2���ӽṹʽΪH-C��C-H��Cԭ��û�й¶Ե��ӣ��γ�2���������ӻ������ĿΪ2��Cԭ���ӻ�������ӻ�����Ϊsp�ӻ���1mol C2H2������������ĿΪ3��6.02��1023����
��3��������NH3����֮���γ��������CH4���Ӳ��ܣ��ʰ����е�ϸߣ�
��4���ȵ����庬����ͬԭ����Ŀ��۵���������Ԫ��̼��һ����������Ԫ�ص���һ�������ﻥΪ�ȵ����壬ΪCO2��N2O��
��5�������к�ɫ����ĿΪ4����ɫ����ĿΪ8��![]() +6��
+6��![]() =4���ʸ��Ȼ���Ļ�ѧʽ��CuCl��������Ũ���ᷢ����������ԭ��Ӧ�����������H2CuCl3����Ӧ�Ļ�ѧ����ʽΪ��CuCl+2HCl=H2CuCl3��
=4���ʸ��Ȼ���Ļ�ѧʽ��CuCl��������Ũ���ᷢ����������ԭ��Ӧ�����������H2CuCl3����Ӧ�Ļ�ѧ����ʽΪ��CuCl+2HCl=H2CuCl3��
�����к�ɫ������Χ��4����ɫ���γ���������ṹ���ھ����������2��ԭ�Ӿ�����apm������Խ��߳���Ϊ4a pm�����ⳤΪ![]() pm����������Ϊ4��
pm����������Ϊ4��![]() g���������ܶ���4��
g���������ܶ���4��![]() gg��(
gg��(![]() ��10-10cm)3=
��10-10cm)3=![]() gcm-3��
gcm-3��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ��ȸʯ�̣��ṹ��ʽ��ͼ��ʾ����������ˮ����ֳҵ��ɱ�������ҩ������Ϊ����DZ���°��ԣ��ѱ���ֹ������ҩ�����й�����ɫ��ȸʯ�̵������У���ȷ����
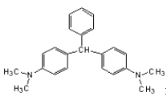
A. ���������е�̼ԭ�ӿ�����ͬһƽ����
B. ��ɫ��ȸʯ����������������
C. ��ɫ��ȸʯ�̿�����ˮ�����巢���ӳɷ�Ӧ
D. ��һ�������£�1mol��ɫ��ȸʯ�̿��Ժ�9mol���������ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ����֪�ס��ҡ��������¶�Ϊ���塣
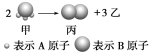
��1��������ķ���ʽ ������A��B��ʾ��A��B����ѡ����ʹ�ã�
��2�������������Ļ�����������������ܶ�Ϊd�����Ħ������Ϊ ������d��ʾ��
��3����״���£�11.2L����������500mLˮ�У�������Һ���ܶ�Ϊ��g/cm3����������Һ�м����ʵ���Ũ��Ϊ ����d���ѱ�ʾ������Ħ�������ã�2���е����ݣ���
������������ӷ���ʽ��
��1���������ڴ�����Һ�� ��
��2��������������Һ�м�������С�մ���Һ�� ��
��3��̼����狀�����Ũ�ռ���Һ��ϣ� ��
��4�������������Һ��ͨ����SO2������ ��
��5�����廯������Һ��ͨ������������ ��
��6����ƫ��������Һ��ͨ������CO2������ ��
��7��������������Һ�м������Ը��������Һ�� ��
��8������п�����ᡢ���������鷴Ӧ�����黯�⣺ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����������ȼ�ϵ����ˮ����ϵͳԭ������ͼ��ʾ��ͼ���л���ˮ���л������C6H10O5��ʾ�������й�˵����ȷ����
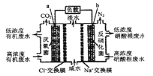
A��b�缫Ϊ�õ�صĸ���
B��b�缫������Һ��pH��С
C��a�缫��Ӧʽ��C6H10O5-24e-+7H2O�T6CO2��+24H+
D���м��ң�Na+�������ң�Cl-��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ���壬�׳����������������д��£�����ⶾ��ȡ5.0 g������Ʒ�������¶�ʹ��ֽ⣬�ֽ���̵��������±����ش��������⣺
�¶ȷ�Χ/�� | ��������/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000���� | 1.44 |
��1���ⶨ�������ھ��������������____________������SO42-��Sԭ�ӵĹ���ӻ���ʽ��____________��H2O�Ŀռ乹����__________________��
��2��������ͭ������ȵ�258~680�����ɵ�����A��A��__________����ѧʽ����A����ˮ�����Һ�����백ˮ���۲쵽��������_____________________________________________�����յõ���Һ�еĺ�ͭԪ�ص�������_________________����ѧʽ���������Ӻ��еĻ�ѧ��������___________________��
��3��������ͭ������ȵ�1000���������ɵ�����C����C�е�ͭ�����ӵĻ�̬�����Ų�ʽ��____________��
��4����ͼ������ͭ����ֽ�õ�һ���¶ȵIJ���ľ���������ͺ��������ͬ��ԭ������
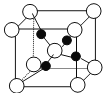
�����¶���_______________��
��ͭԭ�ӵ���λ����_______________��
����֪�þ�����ܶ�Ϊdg��cm-3����������_________________pm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NO2��CO��CO2�ǶԻ���Ӱ��ϴ�����壬�����ǵĺ������ơ��������Ż��������滷������Ч;����
��1����ͼ��ʾ�����õ绯ѧԭ����NO2 ת��Ϊ��Ҫ����ԭ��C��
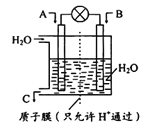
��AΪNO2��BΪO2�����ĵ缫��ӦʽΪ______________________________��
��2����һ����CO2�����״�ȼ�ϵķ�����
CO2��3H2![]() CH3OH��H2O
CH3OH��H2O
��֪��
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H����a kJ��mol��1��
CH3OH(g)��H2O(g) ��H����a kJ��mol��1��
2H2(g)��O2(g)��2H2O(g) ��H����b kJ��mol��1��
H2O(g)��H2O(l) ��H����c kJ��mol��1��
CH3OH(g)��CH3OH(l) ��H����d kJ��mol��1��
���ʾCH3OH(l)ȼ�������Ȼ�ѧ����ʽΪ��_________________________________��
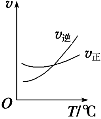
��3������ (COCl2)��һ����Ҫ�Ļ���ԭ�ϣ�����ũҩ��ҽҩ����������ϵ���������ҵ��ͨ��Cl2(g)��CO(g) ![]() COCl2(g)�Ʊ�����ͼΪ�˷�Ӧ�ķ�Ӧ�������¶ȱ仯�����ߣ���ͼΪij��ģ��ʵ���о������������ڸ����ʵ�Ũ����ʱ��仯�����ߡ��ش��������⣺
COCl2(g)�Ʊ�����ͼΪ�˷�Ӧ�ķ�Ӧ�������¶ȱ仯�����ߣ���ͼΪij��ģ��ʵ���о������������ڸ����ʵ�Ũ����ʱ��仯�����ߡ��ش��������⣺
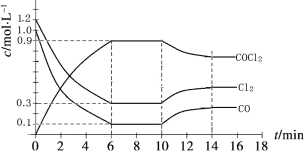
��0~6 min�ڣ���Ӧ��ƽ������v(Cl2)�� ��
���������¶Ȳ��䣬�ڵ�7min ����ϵ�м������������ʸ�2mol����ƽ����____________________
�ƶ�(����������Ӧ�������������淴Ӧ��������������)��
��������ʼͶ��Ũ�ȱ�Ϊc(Cl2)=0.7mol/L��c(CO)=0.5mol/L��c(COCl2)_________ mol/L�����ַ�Ӧ�¶Ȳ��䣬�����մﵽ��ѧƽ��ʱ��Cl2�����������������6minʱCl2�����������ͬ��
�����¶����ߣ��÷�Ӧƽ�ⳣ���仯��������__________��(����������������С������������)
���Ƚϵ�8min��Ӧ�¶�T��8�����15min��Ӧ�¶�T(15)�ĸߵͣ�T��8��_______T(15)(��������������������=��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�ѧ��Ӧ�е������仯��ϵ�ش��������⣺
��1���Ͽ�1molH-H����1molN-H����1molN��N���ֱ���Ҫ���յ�����Ϊ436kJ��391kJ��946kJ����
��1molN2����NH3��______�����������������ų���������______kJ��
��1molH2����NH3��______�����������������ų���������______kJ��
��2������ɴ�������(N2H4)������Դ����֪1molҺ̬�º�������Һ̬�������ⷴӦ���ɵ�����ˮ����ʱ�ų�641.6kJ��������ѧ����ʽ���£�N2H4��2H2O2===N2����4H2O��
���÷�Ӧ������ (��������ԭ������
���÷�Ӧ�ķ�Ӧ�������� ������ڻ���ڣ����������������
��������£�Һ̬��ȼ������0.5molN2ʱ�ų�������Ϊ kJ��
����(N2H4)�����д��ڵĻ�ѧ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ�Ϊ2 L���ܱ�������Ͷ��һ����M��N���з�Ӧ��M��N�����ʵ�����ʱ��ı仯������ͼ��ʾ��
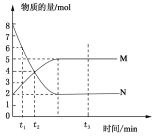
��1��д���˷�Ӧ�Ļ�ѧ����ʽ________________________��
��2��������������˵��������Ӧ�ﵽƽ��״̬����_____��
A����Ӧ��M��N�����ʵ���֮��Ϊ1:1
B���ڻ��������N�������ٷ������ֲ���
C����������ƽ��Ħ����������ʱ��ı仯���仯
D����������ѹǿ����ʱ��ı仯���仯
��3����t3=3����3min����M��ʾ�ķ�Ӧ������ ��
��4����t2ʱ������Ӧ����v���������淴Ӧ����v���棩�Ĵ�С��ϵ�� ��
��5����Ӧ�ﵽƽ���N��ռ����������� ������һλС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������أ�K2FeO4����һ�ּ�������������������һ������Ͷ��ˮ���������������������£�
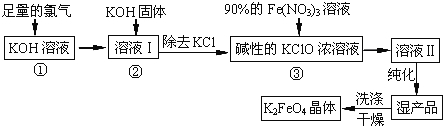
��1����Ӧ��Ӧ���¶Ƚϵ͵�����½��У������¶Ƚϸ�ʱKOH ��Cl2 ��Ӧ���ɵ���KClO3��д�����¶Ƚϸ�ʱKOH ��Cl2��Ӧ�Ļ�ѧ����ʽ ��
��2���ڷ�ӦҺI�м���KOH�����Ŀ���� �����ţ���
A���뷴ӦҺI�й�����Cl2������Ӧ�����ɸ����KClO
B��KOH�����ܽ�ʱ��ų��϶����������������߷�Ӧ����
C��Ϊ��һ����Ӧ�ṩ���ԵĻ���
D��ʹKClO3ת��Ϊ KClO
��3������ҺII�з����K2FeO4�����и���ƷKNO3��KCl����Ӧ���з��������ӷ�Ӧ����ʽΪ ��
��4������ж�K2FeO4�����Ѿ�ϴ�Ӹɾ� ��
��5��������أ�K2FeO4����Ϊˮ��������һ���ŵ�������ˮ��Ӧ���ɽ����������ʣ������ӷ�Ӧ�ǣ� FeO42��+ H2O= Fe(OH)3�����壩+ O2��+
��ɲ���ƽ������Ӧ�����ӷ���ʽ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com