
【题目】氮元素可以形成多种化合物。回答下列问题:
(1)基态氮原子的价电子排布式是____;C、N、O 三种元素电负性从小到大的顺序是________。
(2)肼(N2H4)分子中氮原子轨道的杂化类型是______;肼可用作火箭燃料,燃烧时发生的反应时N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=11038.7kJ·mol-1,若该反应中8molN-H键断裂,则形成的σ键有____mol;肼能与硫酸反应生成N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在______(填字母)。
A.离子键 B.共价键 C.配位键 D.范德华力
(3)氨是________(填“极性”或“非极性”)分子;氨的沸点高于膦(PH3)的原因是________。
(4)将氨气通入硫酸铜水溶液中形成[Cu(NH3)4]SO4深蓝色溶液,[Cu(NH3)4]SO4中阴离子的立体构型是______。
(5)单质铜和镍都是由金属键形成的晶体,元素铜和镍的第二电离能分别为:ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi的原因是_______。某镍白铜合金的立方晶胞结构如图所示。晶胞中镍原子与铜原子的个数比为_______。若合金的密度为dg/cm3,晶胞参数a=_________nm。
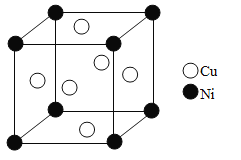
【答案】 2s22p3 C<N<O sp3 11 D 极性 氨分子之间存在氢键,磷分子之间为范德华力 正四面体 铜失去的是全充满的3d10电子,而镍失去的是4s1电子 1:3 ![]() 或
或 ![]()
【解析】试题分析:以N元素化合物为基础,考查电子排布式、电离能、电负性规律、中心原子的杂化方式、化学键、α键、氢键及其对沸点的影响、分子极性、晶体结构等知识,考查考生对晶体结构图识别能力。
解析:(1)N为7号元素,其基态电子排布为1S22s22p3,价电子排布式为2s22p3。C、N、位于同一周期,原子序数依次增大,而同一周期随原子序数递增,电负性增大,所以电负性顺序为C<N<O。正确答案:2s22p3、C<N<O。(2)肼电子式为![]() ,N原子通过δ键连接2个H原子和另1个N原子,还存在1对孤对电子,所以价层电子对数目为4,杂化类型为sp3。2mol N2H4参加反应时,分子中断裂的N-H键为8mol,生成3mol N2中含有3mol δ键,4mol H2O中含有8molδ键,共生成11mol δ键。N2H6SO4是N2H4分子中的两个N的孤对电子分别与H+通过配位键形成N2H62+,再通过离子键与SO42-形成盐,所以晶体内存在离子键、共价键和配位键,不存在的是范德华力。正确答案:sp3、11、D。(3)NH3中心原子成键电子对数目为3,孤对电子对数目为1,总电子对数目是4,所以N原子采用sp3杂化,分子空间结构是三角锥型,负电荷重心位于N原子,正电荷重心位于三个H原子形成的正三角形中心,所以正负电荷重心不重合,NH3为极性分子。液氨除了存在分子间的范德华力外,分子间还存在较强的氢键,而膦仅存在分子间的范德华力,所以氨的沸点高于膦。正确答案: 极性、 氨分子之间存在氢键,磷分子之间为范德华力。 (4)SO42-价层电子对数=
,N原子通过δ键连接2个H原子和另1个N原子,还存在1对孤对电子,所以价层电子对数目为4,杂化类型为sp3。2mol N2H4参加反应时,分子中断裂的N-H键为8mol,生成3mol N2中含有3mol δ键,4mol H2O中含有8molδ键,共生成11mol δ键。N2H6SO4是N2H4分子中的两个N的孤对电子分别与H+通过配位键形成N2H62+,再通过离子键与SO42-形成盐,所以晶体内存在离子键、共价键和配位键,不存在的是范德华力。正确答案:sp3、11、D。(3)NH3中心原子成键电子对数目为3,孤对电子对数目为1,总电子对数目是4,所以N原子采用sp3杂化,分子空间结构是三角锥型,负电荷重心位于N原子,正电荷重心位于三个H原子形成的正三角形中心,所以正负电荷重心不重合,NH3为极性分子。液氨除了存在分子间的范德华力外,分子间还存在较强的氢键,而膦仅存在分子间的范德华力,所以氨的沸点高于膦。正确答案: 极性、 氨分子之间存在氢键,磷分子之间为范德华力。 (4)SO42-价层电子对数=![]() ,中心原子采用sp3杂化,无孤对电子,因此SO42-为空间正四面体结构。正确答案:正四面体。(5)28号元素Ni的核外电子排布式为1s22s2sp63s23p63d84s2,失去1个电子后 核外电子排布式为1s22s2sp63s23p63d84s1;29号元素Cu的核外电子排布式为1s22s2sp63s23p63d104s1,失去1个电子后核外电子排布式为1s22s2sp63s23p63d10,由于3d10是全满的稳定结构,则分别失去1个电子后的Cu+、Ni+中,Cu+更难失去第二个电子,所以Cu的第二电离能更。晶胞中含Ni原子数目8×1/8=1,Cu原子数目6×1/2=3,二者数目比为1:3。晶胞体积a3 nm3=1×10-21 a3 cm3,晶胞中含有1个Cu原子和3个Ni原子,总质量为
,中心原子采用sp3杂化,无孤对电子,因此SO42-为空间正四面体结构。正确答案:正四面体。(5)28号元素Ni的核外电子排布式为1s22s2sp63s23p63d84s2,失去1个电子后 核外电子排布式为1s22s2sp63s23p63d84s1;29号元素Cu的核外电子排布式为1s22s2sp63s23p63d104s1,失去1个电子后核外电子排布式为1s22s2sp63s23p63d10,由于3d10是全满的稳定结构,则分别失去1个电子后的Cu+、Ni+中,Cu+更难失去第二个电子,所以Cu的第二电离能更。晶胞中含Ni原子数目8×1/8=1,Cu原子数目6×1/2=3,二者数目比为1:3。晶胞体积a3 nm3=1×10-21 a3 cm3,晶胞中含有1个Cu原子和3个Ni原子,总质量为![]() g,则合金密度为:
g,则合金密度为: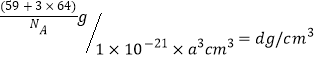 ,
,![]() 。正确答案:铜失去的是全充满的3d10电子,而镍失去的是4s1电子 、1:3、
。正确答案:铜失去的是全充满的3d10电子,而镍失去的是4s1电子 、1:3、![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列变化中发生取代反应的是( )
A.苯与溴水混合,水层褪色
B.乙烯使溴的四氯化碳溶液褪色
C.甲苯制三硝基甲苯
D.苯和氯气在一定条件下生成六氯环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
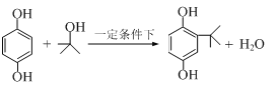
【题目】2—叔丁基对苯二酚是一种重要的食品抗氧剂,现以对苯二酚、叔丁醇为原料,一定条件下经Freidel-Crafts 烷基化反应合成。原理如下:
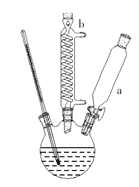
步骤Ⅰ:连接如右图所示装置。
步骤Ⅱ:向三颈烧瓶中加入4.0g 对苯二酚,15mL 浓磷酸,15mL甲苯,启动搅拌器,油浴加热混合液至90℃。从仪器a缓慢滴加 3.5mL叔丁醇,使反应温度维持在 90℃~95℃,并继续搅拌 15min 至固体完全溶解。
步骤Ⅲ:停止搅拌,撤去热浴,趁热转移反应液至分液漏斗中,将分液后的有机层转移到三颈烧瓶中,加入 45mL 水进行水蒸气蒸馏,至无油状物蒸出为止。
步骤Ⅳ:把残留的混合物趁热抽滤,滤液静置后有白色晶体析出,
最后用冷水浴充分冷却,抽滤,晶体用少量冷水洗涤两次,压紧、抽干。
⑴图中仪器a的名称为_____________;仪器b的作用是_____________。
⑵步骤Ⅱ中所加入物质中,有一种物质是催化剂,其化学式为_____________。
⑶已知:叔丁醇熔点是 25℃~26℃,常温下是固体。实验时加入叔丁醇的方法是
_____________。
⑷制备过程应严格控制反应温度90℃~95℃,其原因是_____________。
⑸2—叔丁基对苯二酚粗产品久置会变红,其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习。下列物质的分类不正确的是
A.S02(酸性氧化物) B.氨水(电解质)
C.HN03 (含氧酸) D.氯水(混合物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B![]() 2C。若维持温度和压强不变,当达到平衡时容器的体积为VL,其中C气体的体积占10%。下列推断正确的是 ( )
2C。若维持温度和压强不变,当达到平衡时容器的体积为VL,其中C气体的体积占10%。下列推断正确的是 ( )
①原混合气体的体积为1.2V L
②原混合气体的体积为1.1V L
③反应达到平衡时气体A消耗掉0.05VL
④反应达平衡时气体B消耗掉0.05V L
A.①③ B.②③ C.①④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知三种一元弱酸的酸性强弱 :HX>HY>HZ,则相同pH的NaX、NaY、NaZ溶液,其物质的量浓度由大到小的顺序正确的是
A.NaX、NaY、NaZ B.NaZ、NaY、NaX
C.NaY、NaZ、NaX D.NaX、NaZ、NaY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.H2O与D2O互称同位素
B.氘
C.原子核外有1个电子
D.H与 D中子数不同
E.H218O与D216O的相对分子质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,将2 mol A气体和2 mol B气体通入体积为2 L的密闭容器中发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
(1)x=________。
(2)从开始反应至达到平衡状态,生成C的平均反应速率为________。
(3)A的转化率与B的转化率之比为________。
(4)平衡后A的体积分数为:___________ 。
(5)反应前与平衡后的压强之比为________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com