
(12分)对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1)现有下列6种物质:SO2,SiO2,CaO,MgO,Fe2O3,Na2O2按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①___________________________________________________;
②___________________________________________________。
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol/L的FeCl3溶液,可制得一种红褐色胶体。
①反应的化学方程式为_________________________________。
②如何用较简单的方法判断胶体是否制备成功?___________________________________。
(3)若向该胶体中加入饱和(NH4)2SO4溶液,发生的现象是_________________________;
原因是_______________________________________________。
(1)①SO2常温常压下是气体,其余是固体
②Na2O2是过氧化物,其余为酸性氧化物或碱性氧化物(答案不唯一,合理即可)
(2)①FeCl3+3H2O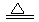 Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
②若该分散系能产生丁达尔效应,则制备成功;否则,不成功
(3)形成红褐色沉淀 (NH4)2SO4电离出的SO中和Fe(OH)3胶粒所带的正电荷,使微粒变大,生成沉淀
【解析】
试题分析:(1)6种物质都为氧化物,其中SO2为气体,其它为固态;Na2O2为过氧化物,其余为酸性氧化物或碱性氧化物;答案为:①SO2常温常压下是气体,其余是固体;②Na2O2是过氧化物,其余为酸性氧化物或碱性氧化物;(2)①制备胶体的原理是利用铁离子水解生成氢氧化铁胶体,反应的化学方程式为FeCl3+3H2O Fe(OH)3(胶体)+3HCl;②溶液不产生丁达尔效应,而氢氧化铁胶体能产生丁达尔效应,答案为:若该分散系能产生丁达尔效应,则制备成功;否则,不成功;(3)(NH4)2SO4电离出的SO42-中和Fe(OH)3胶粒所带的正电荷,使微粒变大,生成红褐色氢氧化铁沉淀;答案为:形成红褐色沉淀;(NH4)2SO4电离出的SO42-中和Fe(OH)3胶粒所带的正电荷,使微粒变大,生成沉淀。
Fe(OH)3(胶体)+3HCl;②溶液不产生丁达尔效应,而氢氧化铁胶体能产生丁达尔效应,答案为:若该分散系能产生丁达尔效应,则制备成功;否则,不成功;(3)(NH4)2SO4电离出的SO42-中和Fe(OH)3胶粒所带的正电荷,使微粒变大,生成红褐色氢氧化铁沉淀;答案为:形成红褐色沉淀;(NH4)2SO4电离出的SO42-中和Fe(OH)3胶粒所带的正电荷,使微粒变大,生成沉淀。
考点:考查物质的分类、胶体的性质,


科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
2014年5月7日南京某建设公司丢失用于材料探伤的放射源Ir—192(铱—192)一枚,经相关部门的努力追查,丢失的放射源于5月10日被回收,Ir—192的放射性会对人体产生很大的伤害。已知Ir元素位于周期表中第6周期第Ⅷ族,原子序数为77,192为该核素的质量数,下列关于Ir—192的说法正确的是( )
A.Ir—192核外含有115个电子 B.Ir为非金属元素
C.Ir—192中子数与质子数的差为38 D.Ir元素与碘元素位于同一周期
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省抚州五校高三5月联考理综化学试卷(解析版) 题型:填空题
【化学选修-物质结构与性质】(15分)
已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大。B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同。
请回答下列问题:
⑴A、B、C、D的第一电离能由小到大的顺序是____________(填元素符号)
⑵化合物BD3的分子空间构型可描述为_________,B的原子轨道杂化类型为________。
⑶已知F元素在人体内含量偏低时,会影响O2在体内的正常运输。已知F2+与KCN
溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物。则F的基态原子价电子排布式为________________。CN-与___________(一种分子)互为等电子体,则1个CN-中π键数目为___________。
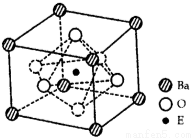
⑷EO2与碳酸钡在熔融状态下反应,所得晶体的晶
胞结构如图所示,则该反应的化学方程式为________
在该晶体中,E4+的氧配为数为____________。若该
晶胞边长为a nm可计算该晶体的密度为__________
g/cm3(阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省宜春市高三模拟考试理综化学试卷(解析版) 题型:选择题
全钒流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置, 其原理如图所示,其中H+的作用是参与正极反应,并通过交换膜定向移动使右槽溶液保持电中性。下列有关说法不正确的是( )

A.放电时当左槽溶液逐渐由黄变蓝,其电极反应式为:VO2+ +e一+2H+=VO2+ +H2O
B.充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为l.0mol
C.充电时,H+由左槽定向移动到右槽
D.充电过程中,右槽溶液颜色逐渐由绿色变为紫色
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省南昌市高二下学期期末考试化学试卷(解析版) 题型:计算题
(7分)现有22g Mg、Al、Zn、Fe多种活泼金属粉末的混合物与200mL含有一定质量的20%硫酸溶液恰好完全反应,得到无水盐70g,求(要求写出计算过程)
(1)硫酸溶液的质量?
(2)生成的气体体积(标准状况)?
(3)硫酸物质的量浓度?
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省南昌市高二下学期期末考试化学试卷(解析版) 题型:填空题
浓H2SO4 密度1.84g/mL,物质的量浓度为18.4 mol/L , 质量分数为98% ,取10mL浓H2SO4和amL水混合得物质的量浓度为Cmol/L,质量分数为b%。下列组合正确的是
(1).若C=9.2则a>10 b>49% (2) 若C=9.2则a>10 b<49%
(3).若b=49则a=18.4 C<9.2 (4) 若b=49则a=18.4 C>9.2
A.(1) (3) B.(1) (4) C.(2) (3) D.(2) (4)
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省南昌市高二下学期期末考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.0.1mol丙烯酸中含有双键的数目为0.1NA
B.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
C.标准状况下,11.2L苯中含有分子的数目为0.5NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省南昌市高一文理分科测试化学试卷(解析版) 题型:选择题
下列说法正确的是
①离子化合物一定含离子键,也可能含极性键或非极性键
②同位素的性质几乎完全相同
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
A.①③⑤ B.②④ C.①③ D.②③④
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省九江七校下学期期中联考高二化学试卷(解析版) 题型:选择题
已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为( )
A.84% B.60% C.91% D.42%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com