
【题目】(1)0.1molCH4 的质量为__________,分子数为__________(用NA表示,下同),原子总数为_________。
(2)500 mL 0.2 mol·L-1的Ba(NO3)2溶液中,NO3-的物质的量的浓度为______________,离子总数为_____________。
(3)在22 .2g某二价金属的氯化物中含有0 .4mol Cl-,此氯化物的摩尔质量为________,该金属元素的相对原子质量为__________。
(4)在标准状况下,由O2和O3组成的混合气体11.2 L,质量为20g。此混合物的平均摩尔质量是________,混合物中O2和O3的体积之比是__________。
【答案】1.6g 0.1NA 0.5NA 0.4mol·L-1 0.3NA 111g·mol-1 40 40g·mol-1 1:1
【解析】
结合n=![]() =
=![]() =
=![]() =cV计算分析即可。
=cV计算分析即可。
(1)0.1molCH4 的质量为16g/mol×0.1mol=1.6g,分子数为0.1NA,每个CH4分子内含有5个原子,则原子总数为0.5NA;
(2)500 mL 0.2 mol·L-1的Ba(NO3)2溶液中NO3-的物质的量的浓度为0.2 mol·L-1×2=0.4 mol·L-1;Ba(NO3)2的物质的量为0.2 mol·L-1×0.5L=0.1mol,离子总数为0.1mol×3×NA mol-1=0.3NA;
(3) 某二价金属的氯化物的化学式为RCl2,在22 .2g某二价金属的氯化物中含有0 .4mol Cl-,此氯化物的物质的量为![]() =0.2mol,则氯化物的摩尔质量为
=0.2mol,则氯化物的摩尔质量为![]() =111g·mol-1,该金属元素的相对原子质量为111-35.5×2=40;
=111g·mol-1,该金属元素的相对原子质量为111-35.5×2=40;
(4)在标准状况下,由O2和O3组成的混合气体11.2 L,则混合气体的物质的量总和为![]() =0.5mol, 此混合物的平均摩尔质量是
=0.5mol, 此混合物的平均摩尔质量是![]() =4040g·mol-;设O2的物质的量为nmol,则O3的物质的量为(0.5-n)mol,此时32n+48(0.5-n)=40,解得:n=0.25,则混合物中O2和O3的体积之比是0.25mol:0.25mol=1:1。
=4040g·mol-;设O2的物质的量为nmol,则O3的物质的量为(0.5-n)mol,此时32n+48(0.5-n)=40,解得:n=0.25,则混合物中O2和O3的体积之比是0.25mol:0.25mol=1:1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:2NO(g)![]() N2(g)+O2(g) △H=-181.5 kJ/mol。某科研小组尝试利用固体表面催化工艺进行NO的分解。若用
N2(g)+O2(g) △H=-181.5 kJ/mol。某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 、
、![]() 、
、![]() 和
和![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是

A.①B.②C.③D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由核电荷数1~18的某些元素组成的单质 A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示的转换关系,A是地壳中含量最多的金属元素。 请回答下列问题:

(1)写出下列物质的化学式:乙__________、丁__________、戊__________.
(2)写出甲物质在工业上的一种主要用途:__________。
(3)写出甲→乙+丙反应的离子方程式:__________。
(4)A→乙+C反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】他米巴罗汀(I)可用于治疗急性白血病,其合成研究具有重要意义,合成路线如图所示。

已知:i.HC![]() CH+
CH+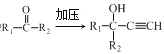
ii.R—NO2![]() R—NH2
R—NH2
iii.R1—NH2+![]() +HCl
+HCl
(1)A中官能团名称是_________。
(2)B的结构简式是________。
(3)D→E的化学方程式是__________。
(4)试剂a是_________。
(5)已知H在合成I的同时,还生成甲醇,G→H所加物质L的结构简式是______。
(6)B的一种同分异构体符合下列条件,其结构简式是________。
①能发生银镜反应
②核磁共振氢谱只有两组吸收峰
(7)D→E的过程中有多种副产物,其中属于高分子化合物的结构简式是_______。
(8)![]() 也是合成他米巴罗汀(I)的一种原料,合成路线如图所示。利用题中所给信息,中间产物的结构简式是_______________。
也是合成他米巴罗汀(I)的一种原料,合成路线如图所示。利用题中所给信息,中间产物的结构简式是_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。

请回答下列问题:
(1)装置A中盛放亚硫酸钠(Na2SO3)的仪器名称是___,其中发生反应的化学方程式为___。
(2)实验过程中,装置B中紫红色变为无色,说明SO2具有___(填“氧化性”或“还原性”),C中无色溶液中出现黄色浑浊,说明SO2具有___(填“氧化性”或“还原性”)。
(3)装置D的目的是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象____;
(4)尾气可以用NaOH溶液吸收,其反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中所含氧原子的物质的量相同的是( )
A.0.3molO2和0.3molH2O
B.![]() 个
个![]() 与0.1molKMnO4
与0.1molKMnO4
C.0.1molCuSO4﹒H2O和0.1molC6H12O6
D.0.1molH2SO4和0.4NA个H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程都与能量变化有关,其中表述不正确的是( )
A.CO(g)的燃烧热是283.0kJ·mol-1,则表示CO(g)燃烧热的热化学方程式为CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
B.铝热反应会放出大量的热,因此常温下就能顺利发生
C.拆开化学键需要吸收能量,形成化学键会释放能量
D.化学电池是把化学能转化为电能的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业常用FeCl3溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与金属铜反应的离子方程式____________________
(2)某小组采取下列步骤从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液。

操作Ⅰ和Ⅱ的操作使用到的主要玻璃仪器有____,滤渣③含有的单质有______。通入气体⑥的化学式为______。
(3)若某腐蚀液中含1.5mol·L-1CuCl2、3.0mol·L-1FeCl2、1.0mol·L-1FeCl3,取200mL腐蚀液按上述步骤回收铜,为充分回收铜,加入①的质量最小为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com