



科目:高中化学 来源:不详 题型:多选题
| A.除去Mg粉中的Al粉:加入足量NaOH溶液后,过滤、洗涤 |
| B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤 |
| C.除去NaHCO3溶液中Na2CO3:加适量稀盐酸 |
| D.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+和Cl- | B.Na+和SO42- | C.Fe3+和SO42- | D.Na+和Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别 |
| B.戊烷(C5H12)有两种同分异构体 |
| C.乙烯、聚氯乙烯和苯分子均含有碳碳双键 |
| D.糖类、油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42- |
| B.向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,则AlO2-结合H+能力比CO32-强 |
| C.向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL5%葡萄糖溶液,加热,未出现红色沉淀。证明葡萄糖中不含醛基 |
| D.检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 |
| B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 |
| C.制乙烯时,用排水法或向上排空气法收集气体 |
| D.制二氧化氮时,用水或NaOH溶液吸收尾气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
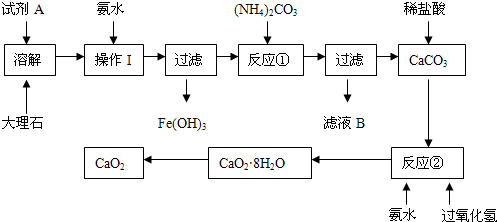
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com