
| n |
| V |
| 0.5mol |
| 0.5L |


科目:高中化学 来源: 题型:
| A、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B、0.5molO3与11.2LO2所含的分子数一定相等 |
| C、28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
| D、500mL 1mol/LNa2SO4溶液中含Na+数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
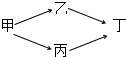 甲、乙、丙、丁四种烃的含氧衍生物,其分子中都含有一个或一个以上的官能团,通过下列转化关系可由甲制取丁:若丁的相对分子质量总为甲的两倍,乙的相对分子质量总大于丙.回答下列问题:
甲、乙、丙、丁四种烃的含氧衍生物,其分子中都含有一个或一个以上的官能团,通过下列转化关系可由甲制取丁:若丁的相对分子质量总为甲的两倍,乙的相对分子质量总大于丙.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和硝酸银溶液反应:Fe+Ag+=Ag+Fe3+ |
| B、氢氧化镁与硫酸溶液反应:H++OH-=H2O |
| C、碳酸钙与醋酸溶液反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
| D、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
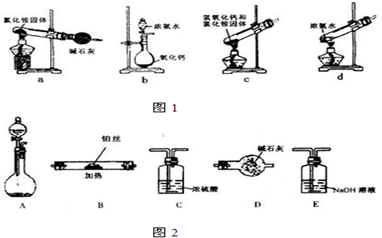
查看答案和解析>>
科目:高中化学 来源: 题型:
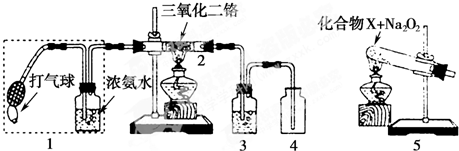
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ?mol-1.向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ?mol-1.向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A、若平衡时A气体在两容器中的体积分数相等,则x一定等于y |
| B、若x:y=1:2,则平衡时,M中的转化率:A>B |
| C、若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% |
| D、若x=1.4,y=1,N中达到平衡时体积为2L,C为0.4mol,则反应起始时N的体积为2.6L |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com