
【题目】由钠、镁、铝、锌4种金属单质中的两种组成的合金共48 g,跟足量的盐酸反应产生22.4 L氢气(标准状况),那么此合金中一定含有的金属是( )
A.Na
B.Mg
C.Al
D.Zn
【答案】D
【解析】解:标况下22.4L氢气的物质的量= ![]() =1mol,故48g金属提供的电子为:1×2=2mol,则提供1mol电子需要金属的质量为48g×
=1mol,故48g金属提供的电子为:1×2=2mol,则提供1mol电子需要金属的质量为48g× ![]() =24g, A.Na在反应中表现+1价,提供1mol电子需要Na的质量为23g/mol×
=24g, A.Na在反应中表现+1价,提供1mol电子需要Na的质量为23g/mol× ![]() =23g,
=23g,
B.Mg在反应中表现+2价,提供1mol电子需要Mg的质量为24g/mol× ![]() =12g,
=12g,
C.Al在反应中表现+3价,提供1mol电子需要Al的质量为27g/mol× ![]() =9g,
=9g,
D.Zn在反应中表现+2价,提供1mol电子需要Zn的质量为65g/mol× ![]() =32.5g,
=32.5g,
提供1mol电子,只有Zn的质量大于24g,其它金属的质量都小于24g,故金属混合物中一定有Zn,
故选D.
标况下22.4L氢气的物质的量= ![]() =1mol,故48g金属提供的电子为:1×2=2mol,则提供1mol电子需要金属的质量为48g×
=1mol,故48g金属提供的电子为:1×2=2mol,则提供1mol电子需要金属的质量为48g× ![]() =24g,再结合化合价计算提供1mol电子需要各金属的质量,据此判断.
=24g,再结合化合价计算提供1mol电子需要各金属的质量,据此判断.


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是___________,其离子的原子结构示意图为___________
(2)①~⑩元素中,最高价氧化物对应的水化物中酸性最强的是________,碱性最强的是________,呈两性的氢氧化物是________;三者相互反应的离子方程为__________,__________,__________。
(3)元素②的一种原子质子数比中子数少1,则m克此种原子形成的简单离子中含有的电子数为______________mol。
(4)在⑦与⑩的单质中,化学性质较活泼的是___________,可用什么化学反应说明该事实(写出反应的化学方程式):___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束,有固体剩余,则反应后溶液中肯定没有的阳离子是
A.Fe2+B.Fe3+C.Cu2+D.H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类或归类错误的是
A. 混合物:生铁、空气、碱石灰B. 化合物:烧碱、氧化镁、硫酸
C. 盐:食盐、石灰石、生石灰D. 单质:石墨、臭氧、水银
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水份、空气中的氧气以及光照、受热而引起的.已知:
氧化性:IO ![]() >Fe3+>I2;还原性:S2O
>Fe3+>I2;还原性:S2O ![]() >I﹣
>I﹣
3I2+6OH﹣═5I﹣+IO ![]() +3H2O KI+I2=KI3
+3H2O KI+I2=KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①加KSCN溶液显红色,该红色物质是(用化学式表示);CCl4中显紫红色的物质是(用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为、 .
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境中KI与氧气反应的化学方程式: . 将I2溶于KI溶液,在低温条件下,可制得KI3H2O.该物质作为食盐加碘剂是否合适?(填“是”或“否”),并说明理由: .
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 .
A.Na2S2O3
B.AlCl3
C.Na2CO3
D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe2+: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 摩尔是物质的质量的单位B. 碳的摩尔质量为12g
C. 阿伏加德罗常数约为6.02×1023mol﹣1D. 气体摩尔体积为22.4L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质。下列判断正确的是
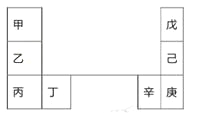
A. 金属性:甲>乙>丁
B. 原子半径:辛>己>戊
C. 丙和庚的原子核外电子数相差11
D. 乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是
A. 已知甲烷的燃烧热为890.3 kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJmol-1
B. 已知强酸和强碱的稀溶液反应的中和热为57.3 kJmol-1,则CH3COOH+OH—=CH3COO—+H2O ΔH=-57.3 kJmol-1
C. 一定条件下,将0.5mol N2和1.5mol H2置于密闭容器中,充分反应生成NH3(g),放出热量19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJmol-1
2NH3(g) ΔH=-38.6 kJmol-1
D. 已知1g N2H4(l)和足量H2O2(l)反应生成氮气和水蒸气,放出热量20.05kJ,该热化学方程式可表示为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6 kJmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com