
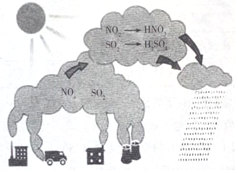
| A. | 图示过程表示了地球臭氧层的破坏过程 | |
| B. | 图中涉及的氧化物均为酸性氧化物 | |
| C. | 机动车尾气含有N的氧化产物 | |
| D. | 图示中描述的过程所涉及的反应均为氧化还原反应 |
分析 A.图示过程中没有臭氧参与反应;
B.NO不是酸性氧化物;
C.空气中的氮气在发动机中会与氧气反应生成氮的氧化物;
D.三氧化硫与水反应生成硫酸时,没有元素化合价的变化.
解答 解:A.图示过程中没有臭氧参与反应,没有表示了地球臭氧层的破坏过程,表示N、S氧化物的转化,故A错误;
B.氮气与氧气反应生成NO,NO不是酸性氧化物,属于不成盐氧化物,故B错误;
C.空气中的氮气在发动机中会与氧气反应生成氮的氧化物,所以机动车尾气含有N的氧化产物,故C正确;
D.三氧化硫与水反应生成硫酸时,没有元素化合价的变化,不是氧化还原反应,故D错误.
故选C.
点评 本题考查了氧化还原反应、氧化物的分类以及环境保护,题目难度不大,注意从化合价的角度分析氧化还原反应,侧重于考查学生 的分析能力和应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 能使紫色石蕊试剂变红的溶液中:NO3-、I-、Ba2+、Fe2+ | |
| B. | 含有大量Fe3+的溶液中:SCN-、I-、K+、Br- | |
| C. | pH=1的溶液中:K+、Br-、SO42-、Al3+ | |
| D. | 澄清石灰水中:Na+、K+、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
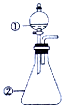 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) | 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠混合溶液 | 立即产生气泡 |
| B | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| C | 氯化铁溶液 | 淀粉碘化钾溶液 | 溶液变为蓝色 |
| D | 硫酸亚铁溶液 | 过氧化钠固体 | 产生气泡和白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
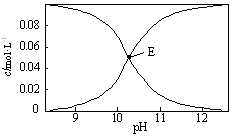 20℃时,配制一组c(Na2CO3)+c(NaHCO3)=0.100mol•L-1的混合溶液,溶液中c(HCO3-)、c(CO32-)与pH的关系如图所示.下列指定溶液中微粒的物质的量浓度关系正确的是( )
20℃时,配制一组c(Na2CO3)+c(NaHCO3)=0.100mol•L-1的混合溶液,溶液中c(HCO3-)、c(CO32-)与pH的关系如图所示.下列指定溶液中微粒的物质的量浓度关系正确的是( )| A. | pH=9的溶液中:c(HCO3-)>c(H2CO3)>c(CO32-) | |
| B. | c(HCO3-)=c(CO32-)的E点溶液中:c(OH-)+c(CO32-)>c(H+)+c(H2CO3)+0.050 mol•L-1 | |
| C. | pH=11的溶液中:c(Na+)<2c(CO32-)+c(HCO3-) | |
| D. | 0.100 mol•L-1的Na2CO3溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液pH>7,则一定有:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) | |
| B. | 1L0.1mol•L-1CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)≠c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 物质的量浓度分别为c1和c2的两种醋酸溶液,若其pH分别为a和a+1,则c1>10c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2NH3,该反应中的氧化剂是N2.
2NH3,该反应中的氧化剂是N2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
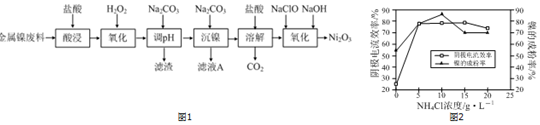
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com