
【题目】(题文)在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。

(1)该混合液中,NaCl的物质的量为______mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为________mol·L1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
【答案】 0.4 19.0 0.2 0.2 1.2
【解析】
试题(1)根据图像可知钠离子的浓度是1.0mol/L,所以溶液中氯化钠的浓度是1.0mol/L,所以该混合液中,NaCl的物质的量为1.0mol/L×0.4L=0.4mol.;溶液中镁离子的浓度是0.5mol/L,所以溶液中氯化镁的浓度是0.5mol/L,则含溶质MgCl2的质量为0.4L×0.5mol/L×95g/mol=19.0g。
(2)溶液中氯离子的浓度是3.0mol/L,所以根据溶液显电中性可知溶液中钙离子的浓度是(3.0mol/L-1.0mol/L-2×0.5mol/L)÷2=0.5mol/L,因此该混合液中CaCl2的物质的量为0.5mol/L×0.4L=0.2mol。将该混合液加水稀释至体积为1 L,由于稀释后溶质的物质的量不变,则稀释后溶液中Ca2+的物质的量浓度为![]() 。
。
(3)溶液中氯离子的物质的量是0.4L×3mol/L=1.2mol,所以根据方程式Ag++Cl-=AgCl↓可知向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到氯化银沉淀的物质的量是1.2mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
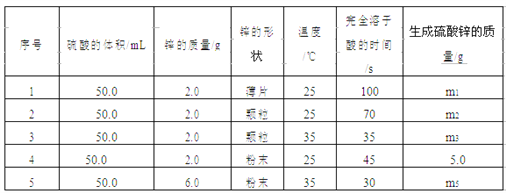
(1)本实验中实验 2 和实验 3 表明________对反应速率有影响。
(2)若采用与实验 1 完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
Ⅱ.某温度时,在 5 L 的容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
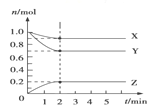
(3)反应开始至 2 min,Y 的平均反应速率_______mol/(L·min)。
(4)反应开始至 2 min,X 的转化率________。
(5)写出 X、Y、Z 的反应方程式________________。
Ⅲ.(6)C2H5OH-O2-KOH 溶液燃料电池,则负极电极反应式为________。反应进行后,溶液的 pH________(填“增大”、“减小”或“不变”)。
(7)将该反应 Fe+2FeCl3=3FeCl2 设计成原电池。则负极材料为_______,正极材料为______。正极反应式________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+I2(g)![]() 2HI(g)△H<0,在带有活塞的密闭容器中达到平衡,下列说法中不正确的是
2HI(g)△H<0,在带有活塞的密闭容器中达到平衡,下列说法中不正确的是
A. 容器体积不变,升温正、逆反应速率均增大
B. 温度、压强均不变,充入氦气,正、逆反应速率不变
C. 温度不变,压缩气体的体积,平衡不移动,颜色加深
D. 容积、温度不变,充入氦气后,正、逆反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸在水溶液中建立如下电离平衡: CH3COOH![]() H++ CH3COO-,若只改变一个条件,一定可以使c(CH3COOH)/c(H+)减小的是
H++ CH3COO-,若只改变一个条件,一定可以使c(CH3COOH)/c(H+)减小的是
A. 通氯化氢气体 B. 加入少量醋酸钾固体
C. 加入少量氢氧化钠固体 D. 通入少量冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已称量好的氯化钠固体配制500 mL 0.40 mol·L-1氯化钠溶液, 仪器不用的是
①250 mL容量瓶 ②托盘天平 ③500 mL容量瓶④胶头滴管
⑤烧杯 ⑥玻璃棒 ⑦药匙
A.③⑥⑦B.①②④C.①②⑦D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )
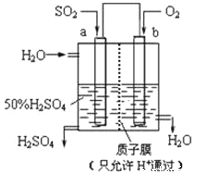
A. a为正极,b为负极
B. 生产过程中a电极质量减轻
C. 电子从b极向a极移动
D. 负极反应式为:SO2+2H2O﹣2e﹣=SO42﹣+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I下面是几种实验中常用的仪器:
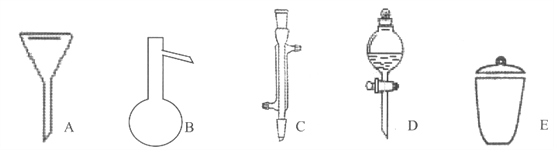
写出序号所代表的仪器的名称:
A__________;B__________;C__________;D__________;E__________
II实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、天平、量筒和__________________。
(2)用托盘天平称取氯化钠固体,其质量为__________g。
(3)下列主要操作步骤的正确顺序是____________________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度__________ (填“偏高”或“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Na2O2投入到FeCl3溶液中,对可观察到的现象描述较准确的是( )
A.生成白色沉淀B.生成红褐色沉淀、有气体
C.有气泡产生D.生成红褐色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com