
A、NF3的形成过程用电子式可表示为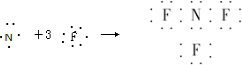 |
| B、NF3的氧化性大于F2 |
| C、NF3分子空间构型为三角锥形 |
| D、NH4F中既有离子键又有极性共价键 |
 ,故A正确;
,故A正确;

科目:高中化学 来源: 题型:
| A、NaCl |
| B、Cl2 |
| C、NaClO |
| D、HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和碳酸钠溶液中通入过量的CO2:CO32-+H2O+CO2=2HCO3- |
| B、氯气跟水反应:Cl2+H2O=2H++Cl-+ClO- |
| C、过氧化钠投入水中:Na2O2+H2O=2Na++2OH-+O2↑ |
| D、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
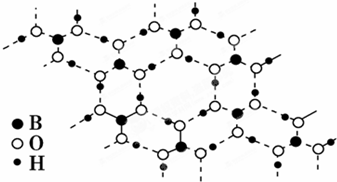
| A、正硼酸晶体属于原子晶体 |
| B、H3BO3分子的稳定性与氢键有关 |
| C、1 mol H3BO3晶体中含有3 mol氢键 |
| D、分子中硼原子最外层为8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定符合 |
| B、一定不符合 |
| C、两种情况都有可能 |
| D、缺条件无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | ||
| B、在碳酸氢钠溶液中加入过量的氢氧化钡溶液:Ba2++OH-+HCO3-═BaCO3↓+H2O | ||
C、用新制的氢氧化铜悬浊液检验乙醛中的醛基:CH3CHO+2Cu(OH)2+OH-
| ||
| D、向Ca(ClO)2溶液中通入过量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+2H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.请回答下列问题:
(Ⅰ)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.请回答下列问题:| 7 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com