
分析 (1)先根据v=$\frac{△c}{△t}$计算出以C表示2分钟内平均反应速率,然后根据化学反应速率与化学计量数成正比计算出以A表示2分钟内平均反应速率;根据n=cV计算出生成C的物质的量,然后根据反应方程式计算出反应消耗B的物质的量,再根据转化率=$\frac{{n}_{B消耗}}{{n}_{B总}}$×100%;
(2)pH=5的溶液中氢离子浓度为1.0×10-5mol/L,然后根据电荷守恒、水的离子积计算;
(3)二者恰好反应生成硫酸钡沉淀,根据Ksp(BaSO4)=1×10-10计算;
(4)钢铁发生吸氧腐蚀时,正极上氧气得电子发生还原反应.
解答 解:(1)用A表示2分钟内平均反应速率速率为:v(A)=$\frac{1.2mol/L}{2min}$=0.6 mol/(L•min),速率之比等于对应物质的化学计量数之比,v(A)=$\frac{2}{3}$v(C)=0.4 mol/(L•min);
反应生成C的物质的量为:1.2mol/L×1L=1.2mol,根据反应可知平衡时消耗B的物质的量为:1.2mol×$\frac{1}{3}$=0.4mol,则B的转化率为:$\frac{0.4mol}{1mol}$×100%=40%,
故答案为:0.4 mol/(L•min);40%;
(2)25℃,0.1mol/L的NH4Cl溶液pH=5,c(H+)=1.0×10-5mol/L,氢氧根离子浓度为c(OH-)=1.0×10-9mol/L,根据氯化铵溶液中的电荷守恒可得:c(Cl-)-c(NH4+)=c(H+)-c(OH-)=1.0×10-5mol/L-1.0×10-9mol/L=(1.0×10-5-1.0×10-9)mol/L,
故答案为:(1.0×10-5-1.0×10-9)mol/L;
(3)将浓度均为0.1mol/L的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中为饱和溶液,则存在c(Ba2+)×c(SO42-)=1×10-10,c(Ba2+)=1×10-5mol/L,
故答案为:1×10-5;
(4)钢铁发生吸氧腐蚀时构成原电池,铁易失电子作负极,碳作正极,正极上氧气得电子和水反应生成氢氧根离子,正极电极反应式为:2H2O+O2+4e-=4OH-,
故答案为:2H2O+O2+4e-=4OH-.
点评 本题考查较为综合,涉及化学平衡计算、难溶物溶解平衡及计算、盐的水解原理及其应用、金属腐蚀等知识,题目难度中等,注意掌握电荷守恒的含义,明确化学反应速率、转化率的概念及表达式,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 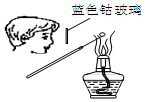 检验Na2CO3 中的Na+ | B. | 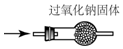 除去CO中混有的CO2 | ||
| C. | 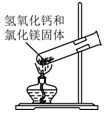 制取氨气 | D. | 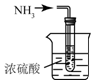 吸收氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为:CH2=CH2 | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | 醋酸的分子式:CH3COOH | |
| D. | 乙醇的结构式为: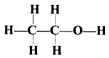 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
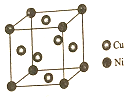 东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 混合物 | SiO2 (Si) | CO2(SO2) | NaHCO3(Na2SiO3) | SiO2(NaCl) |
| 除杂试剂 | 空气 | 饱和碳酸氢钠溶液 | 水、足量二氧化碳 | 水 |
| 除杂方法 | 加热 | 洗气 | 过滤、蒸发 | 过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com