
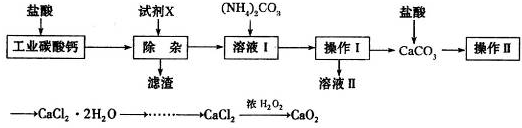
(18分)以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—99.3%)的工艺流程为(可能用到的原子量Cl 35.5 Ca 40 O 16)
(1)CaCO3与盐酸反应的离子方程式 。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:
① ,②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括 、 、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 .(只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为 。
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2012届广州市花都区高三9月份调研测试理科综合试卷(化学部分) 题型:填空题
(18分)以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—99.3%)的工艺流程为(可能用到的原子量Cl 35.5 Ca 40 O 16)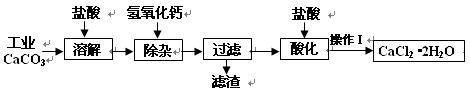
(1)CaCO3与盐酸反应的离子方程式 。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:
① ,②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括 、 、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 .(只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广州市花都区高三9月份调研测试理科综合试卷(化学部分) 题型:填空题
(18分)以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—99.3%)的工艺流程为(可能用到的原子量Cl 35.5 Ca 40 O 16)
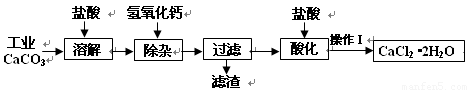
(1)CaCO3与盐酸反应的离子方程式 。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:
① ,②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括 、 、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 .(只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+、Cu2+等杂质)生产医药级二水合氯化钙(CaCl2?2H2O的质量分数为97.0%~103.0%)的主要流程如下:
![]()
![]()
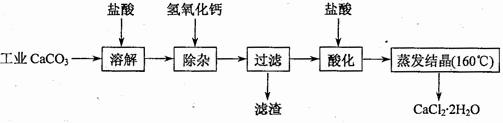
![]() (1)除杂操作是加入氢氧化钙,调节溶液的pH,以除去溶液中的少量Al3+、Fe3+、Cu2+。
(1)除杂操作是加入氢氧化钙,调节溶液的pH,以除去溶液中的少量Al3+、Fe3+、Cu2+。
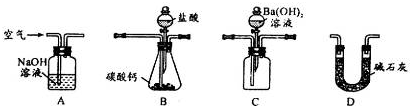
①已知Cu(OH)2的KSP=2×l0-20 (mol/L)3。要使0. 2mol?L-1CuCl2溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一,此时Al3+、Fe3+已沉淀完全),则应向溶液里加入强碱溶液至溶液的pH为______。
②检验Fe(OH)3已经沉淀完全的实验操作是 ;
③如果将氢氧化钙改为纯净的碳酸钙,请用离子方程式表达除去溶液中Fe3+的过程:
。
![]() (2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其主要目的是: 。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其主要目的是: 。
![]() (3)测定样品中Cl-含量的方法是:a.称取0.75g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05mol?L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
(3)测定样品中Cl-含量的方法是:a.称取0.75g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05mol?L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
![]() ①上述测定过程中需要溶液润洗的仪器有 。
①上述测定过程中需要溶液润洗的仪器有 。
![]() ②量取25.00mL待测溶液于锥形瓶中时,如果开始滴定管的液面读数为5.10mL,左手控制滴定管的活塞,使待测溶液流入锥形瓶中,眼睛注视着 ,直到 ,迅速关闭活塞。
②量取25.00mL待测溶液于锥形瓶中时,如果开始滴定管的液面读数为5.10mL,左手控制滴定管的活塞,使待测溶液流入锥形瓶中,眼睛注视着 ,直到 ,迅速关闭活塞。
③计算上述所得样品中CaCl2?2H2O的质量分数为 。
![]() ④若用上述办法测定的样品中CaCl2?2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有 ; 。
④若用上述办法测定的样品中CaCl2?2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有 ; 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com