
| A. | 异戊二烯分子里的所有原子不可能在同一平面上 | |
| B. | 浓氨水洗涤做过银镜反应的试管 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 聚合物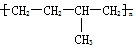 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
科目:高中化学 来源: 题型:解答题
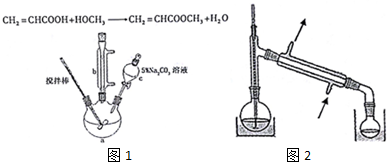
| 沸点 | 溶解性 | ||
| 丙烯酸 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸丙烯酸甲酯 | 80.5℃ | 难溶于水易溶于有机溶剂 | 易挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用100mL容量瓶配制70mL0.1mol/L盐酸 | |
| B. | 用托盘天平称取25.20g氯化钠 | |
| C. | 用20mL的量筒量取13.86mL NaOH溶液 | |
| D. | 用蒸发皿加热胆矾晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na投入到水中:Na+H2O═Na++OH-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 三氯化铁溶液中加入铜粉:Fe3++Cu═Fe2++Cu2+ | |
| D. | 将氯气通入冷的氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与硫酸产生氢气多 | B. | 与氢氧化钠溶液产生氢气多 | ||
| C. | 两者产生氢气一样多 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20.0g | B. | 19.2g | C. | 40.0g | D. | 80.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.3×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com