
分析 8.1g铝完全反应,令生成标准状况下的H2的体积为V,要氢氧化钠的物质的量为xmol,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2×27g 2mol 3×22.4L
8.1g xmol V
则:$\frac{2×27g}{8.1g}=\frac{2mol}{xmol}=\frac{3×22.4L}{V}$,由此分析解答.
解答 解:8.1g铝完全反应,令生成标准状况下的H2的体积为V,要氢氧化钠的物质的量为xmol,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2×27g 2mol 3×22.4L
8.1g xmol V
则:$\frac{2×27g}{8.1g}=\frac{2mol}{xmol}=\frac{3×22.4L}{V}$,所以V=$\frac{8.1g}{2×27g}$×3×22.4L=10.08L,x=0.3mol
答:(1)生成的气体在标准状况下的体积为10.08L;
(2)需要氢氧化钠的物质的量为0.3mol.
点评 本题考查根据方程式的计算、常用化学计量数的计算,比较基础,掌握根据方程式计算的格式.


科目:高中化学 来源: 题型:填空题
| NaCl | KCl | MgO | AlCl3 | SiC | 晶体B | CCl4 | CBr | |
| 熔点/℃ | 801 | 772 | 2800 | 190 | 2600 | 2300 | -22.9 | 90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是CO2 | B. | 一定是SO2 | ||
| C. | 可能是CO2或SO2 | D. | 一定是CO2和SO2混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 过程①中除去粗盐中的SO${\;}_{4}^{2-}$、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 过程②中应先通入NH3再通入CO2气体 | |
| C. | 过程③中结晶出的MgCl2•6H2O要在HCl氛围中加热脱水制得无水MgCl2 | |
| D. | 从第⑤~⑥步的目的是浓缩、富集溴单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | Y | |
| Z | W |
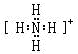 ,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中滴入稀盐酸,生成无色气体,说明原溶液中有一定有CO32- | |
| B. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ | |
| C. | 加入硝酸银溶液有白色沉淀产生,则一定有Cl- | |
| D. | 分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
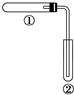 用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )
用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )| ①中实验 | ②中现象 | |
| A | 铁粉与水蒸气加热 | 肥皂水冒泡 |
| B | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
| C | NaHC03固体受热分解 | 澄済石灰水变浑浊 |
| D | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
| A. | 答案A | B. | 答案B | C. | 答案C | D. | 答案D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2发生还原反应 | |
| B. | 氧化剂为I2 | |
| C. | 还原剂为KClO3 | |
| D. | 反应中KClO3被还原为Cl2,I2被氧化为KIO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com