
分析 (1)由2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol、H2O(g)═H2O(l)△H=-44.0KJ/mol来计算;
(2)利用2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol结合盖斯定律来写出CO和 H2O(g)作用生成CO2和H2的热化学方程式;
(3)根据化学平衡的三段法计算、平衡常数的计算来分析;
(4)氢气为负极,失去电子,在碱性电解质溶液中,负极生成水.
解答 解:(1)由2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol、2H2O(g)═2H2O(l)△H=-88.0KJ/mol,即2mol氢气燃烧生成液态水,放出的热量为483.6kJ+88kJ=571.6kJ,
则1mol氢气燃烧生成液态水时放出的热量为$\frac{571.6kJ}{2}$=285.8kJ,
故答案为:-285.8 kJ•moL-1;
(2)由①2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、②2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol,根据盖斯定律可知$\frac{①-②}{2}$得CO(g)+H2O(g)═CO2(g)+H2(g),
△H=$\frac{-566kJ/mol-(-483.6kJ/mol)}{2}$=-41.2kJ/mol,即热化学反应方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol,
故答案为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol;
(3)CO(g)+H2O(g)═CO2(g)+H2(g)
开始 0.2 1 0 0
转化 x x x x
平衡 0.2-x 1-x x x
t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则$\frac{x×x}{(0.2-x)×(1-x)}$=1,
解得x=$\frac{1}{6}$,
所以CO的转化率为$\frac{\frac{1}{6}}{0.2}$×100%=83.3%
该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,
故答案为:83.3%;变小;逆;
(4)氢气为负极,失去电子,在碱性电解质溶液中,负极生成水,则负极反应式为H2-2e-+2OH-═2H2O,
故答案为:H2-2e-+2OH-═2H2O.
点评 本题综合性较强,涉及热化学反应方程式的计算,化学平衡的计算及移动,原电池的电极反应,注重对高考热点的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 它可使酸性高锰酸钾溶液褪色 | B. | 它能使溴水褪色 | ||
| C. | 它可与银氨溶液反应 | D. | 若催化加氢,最终产物是 C10H20O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N60与N2都是氮的同素异形体 | |
| B. | N60转化为N2属化学变化 | |
| C. | N60的总能量高于N2的总能量 | |
| D. | N60变为 N2的反应是放热反应,说明N60比N2更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
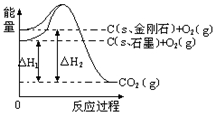
| A. | 石墨和金刚石互为同位素 | |
| B. | 金刚石的总能量比石墨的总能量高1.9 kJ | |
| C. | C(石墨)═C(金刚石)△H=+1.9 kJ•mol-1 | |
| D. | C(s,石墨)═C(s,金刚石)△H=+1.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期ⅣA族 | B. | 第二周期VIA族 | C. | 第三周期VIA族 | D. | 第三周期ⅣA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com