
【题目】香豆素(![]() )是一种天然香料,常存在于黑香豆、兰花等植物中。
)是一种天然香料,常存在于黑香豆、兰花等植物中。
⑴香豆素的分子式是________,属于________(填“无机化合物”或“有机化合物”)。
⑵香豆素能使溴水褪色,因为结构中含________(填官能团名称),其与Br2发生___反应(填反应类型)。
⑶香豆素具有还原性,向酸性高锰酸钾溶液加入足量的香豆素,充分振荡,实验现象为___。
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】(1)某种烃A对氢气的相对密度为36 ,该烃中碳氢两元素的质量比为5∶1,求:
①确定该烃的分子式____________
②如果该烃的一氯取代物有4种,写出该烃的结构简式_______________
③烃A可由另一种烃B通过加成反应而制得,则烃B的可能的是(任写一种可能的结构简式)_______________
(2)写出下列反应的化学方程式
①甲苯生成TNT_________________________________;
②丙烯与氯化氢的加成反应___________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】樱桃是一种抗氧化的水果,对人体有很大的益处,樱桃中含有一种羟基酸![]() 具有健脾作用。下列有关说法正确的是
具有健脾作用。下列有关说法正确的是
A.该羟基酸含有3种官能团
B.通常条件下,该羟基酸可以发生取代、氧化和加成反应
C.该羟基酸可以在Cu的催化下被O2氧化成醛
D.含1mol该羟基酸的溶液可与含2mol氢氧化钠的溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组模拟侯德榜制碱法制取Na2CO3的过程如下:

已知:①反应Ⅰ的化学方程式为:NH3+H2O+CO2=NH4HCO3
②滤液含NH4Cl等溶质
⑴反应Ⅱ为复分解反应,写出该反应的化学方程式______。
⑵验证滤液中含Cl-离子的实验方法和现象为______。
⑶反应Ⅲ的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,完成下面小题。
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。其工业合成原理为:
①2Fe(OH)3+3NaClO+10NaOH=2Na2FeO4+6NaCl+8H2O
②Na2FeO4+2KOH![]() K2FeO4↓+2NaOH
K2FeO4↓+2NaOH
高铁酸钾与水反应生成Fe(OH)3胶体和氧气等。
【1】关于反应①下列说法正确的是
A.Fe(OH)3得到电子B.NaClO失去电子
C.NaClO被还原D.NaOH是氧化剂
【2】反应②属于
A.化合反应B.分解反应C.置换反应D.复分解反应
【3】关于反应②下列说法正确的是
A.减小Na2FeO4浓度能够加快反应速率
B.增大KOH浓度能够加快反应速率
C.升高温度可以减慢反应速率
D.加入足量的KOH可以使Na2FeO4100%转化为K2FeO4
【4】NaClO属于
A.氧化物B.酸C.碱D.盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列溶液中水的电离程度最小的是
A. pH=11的氨水 B. 0.01 mol/L的Na2CO3溶液
C. 0.01 mol/L的盐酸 D. pH=4的NaHSO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一。SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2O(g) △H<0
4N2(g)+6H2O(g) △H<0
(1)氮氧化物破坏臭氧层原理为:①NO+O3![]() NO2+O2 ②NO2+O
NO2+O2 ②NO2+O![]() NO+O2。常温下反应①的平衡常数为K1,反应②的平衡常数为K2,则反应O3+O
NO+O2。常温下反应①的平衡常数为K1,反应②的平衡常数为K2,则反应O3+O![]() 2O2的平衡常数K =_______(用K1、K2表示)。氮氧化物在该反应中的作用是___________。
2O2的平衡常数K =_______(用K1、K2表示)。氮氧化物在该反应中的作用是___________。
(2)SCR法除NO时,投料比一定时有利于提高NO平衡转化率的反应条件是________、________。
(3)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图。

①工业上选择催化剂乙的原因是______________;
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率__________(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时,NO转化率降低的原因可能是(________)。
A.温度高于210oC,反应放热,平衡逆移
B.催化剂活性降低
C.温度高于210oC,发生了副反应
(4)二甲醚(CH3-O-CH3)代替氟利昂作为制冷剂可减少臭氧空洞。若用二甲醚-O2燃料电池作为电源,利用电解法制备纳米Cu2O,其装置如图所示。
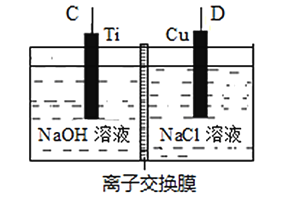
①上述装置中D电极应连接二甲醚燃料电池中通_______(填“CH3-O-CH3”或“O2”)的一极,该电解池中离子交换膜为_____离子交换膜(填“阴”或“阳”)。
②该电解池的阳极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)NO2(g)△H=+57kJmol﹣1,在温度为T时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的为( )
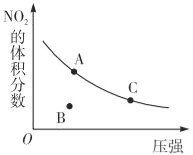
A.A、C两点的反应速率:v(A)>v(C)
B.A、C两点气体的颜色:A深,C浅
C.B点正逆反应速率:v(正)>v(逆)
D.A、C两点气休的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。设NA为阿伏加德罗常数的数值,下列说法正确的是( )
Na2S+2CO2↑。设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 0.1 mol·L-1的Na2SO4溶液中含SO42-的数目为0.1NA
B. 1 mol 13C原子所含中子数为6NA
C. 78 g Na2S中所含离子总数为2NA
D. 标准状况下,2.24 L CO2所含氧原子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com