
【题目】已知氧化性:Cl2>IO3->Fe3+>I2,则对实验结果分析或预测正确的是( )
A.加碘食盐溶液中滴入少量白醋和淀粉 KI 溶液,溶液变蓝色,说明可能是 IO![]()
B.加碘食盐溶液中加入过量氯水后加淀粉,溶液不变蓝色,说明不可能是 I-
C.FeI2 溶液中滴加少量氯水,溶液中一定有 Fe3+生成
D.FeCl2 溶液中滴加足量碘水和 KSCN 溶液,溶液一定变红色
【答案】A
【解析】
A.由于氧化性IO3->I2,加碘食盐溶液中滴入少量白醋和淀粉KI溶液,溶液变蓝色,可能是IO3-在酸性条件下与I-发生氧化还原反应,生成I2,使得淀粉溶液变蓝,A选项正确;
B.加碘食盐溶液中加入过量氯水后加淀粉,溶液不变蓝色,可能是过量的氯水将I-氧化为![]() ,从而溶液不变蓝,B选项错误;
,从而溶液不变蓝,B选项错误;
C.由于氧化性Fe3+>I2,所以还原性:I->Fe2+,则FeI2溶液中滴加少量氯水,Cl2先氧化I-,Cl2的量较少,则不一定会氧化Fe2+,因此溶液中不一定有Fe3+生成,C选项错误;
D.氧化性Fe3+>I2,FeCl2溶液中滴加足量碘水和KSCN溶液,I2不能将Fe2+氧化生成Fe3+,则溶液不会变红色,D选项错误;
答案选A。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如下图所示(电极未标出),下列说法不正确的是( )
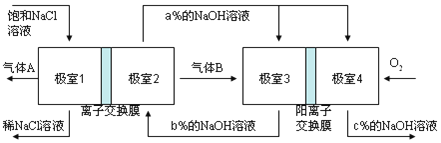
A. 气体B为H2
B. 相同条件下,当电解池生成2L Cl2,理论上燃料电池应消耗1L O2
C. 极室1 与极室2之间的离子交换膜也为阳离子交换膜
D. 溶液a、b、c的pH大小顺序为:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X 为阳离子交换膜。下列有关说法正确的是

A. 反应一段时间后,乙装置中生成的氢氧化钠在铁极区
B. 乙装置中铁电极为阴极,电极反应式为Fe-2e-= Fe2+
C. 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
D. 通入氧气的一极为正极,发生的电极反应为O2 - 4e- + 2H2O = 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应能发生并用于化工生产的是()
A.制盐酸:Cl2+H2![]() 2HCl
2HCl
B.制取镁:MgCl2(溶液)![]() Mg+Cl2
Mg+Cl2
C.制乙烯:C2H5OH![]() CH2=CH2+H2O
CH2=CH2+H2O
D.制乙醇:CH2=CH2+H2O![]() C2H5OH
C2H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+![]() O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则反应④2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变为
A.488.3 kJ/molB.-224.15 kJ/mol
C.-488.3 kJ/molD.244.15 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1 molH—H键吸收436 kJ能量,断裂1mol Cl—Cl键吸收243kJ能量,形成1 molH—Cl键放出431 kJ能量。
H2+Cl2===2HCl的化学反应可用如图表示:
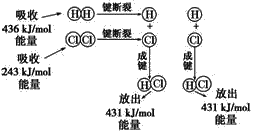
请回答下列有关问题:
(1)反应物断键吸收的总能量为____。
(2)生成物成键放出的总能量为____。
(3)1molH2和1molCl2反应生成2molHCl是_____(填“吸收”或“放出”)能量的反应,其能量值为____。
(4)反应物总能量___(填“>”或“<”)生成物总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(2Na2CO3·3H2O2)晶体性质具有Na2CO3和H2O2 的双重性,被广泛用于氧气发生、漂白杀菌、污水处理、金属表面处理以及高分子聚合控制等。
(1)Na 原子的核外电子排布式为_____,O 原子核外 L 层上有_______种能量不同的电子,H2O2 的电子式是_____________________________________________
(2)设计一个简单实验,比较O 元素与其同主族短周期元素的非金属性强弱(简要写出实验方法、实验现象和结论)_____;并用原子结构知识对作出的结论进行解释_____。
(3)用一个离子方程式表示过碳酸钠溶液显碱性的原因________________________。
(4)高锰酸根离子(![]() )水对人体危害极大,可用过碳酸钠改性赤泥进行处理,反应如下:
)水对人体危害极大,可用过碳酸钠改性赤泥进行处理,反应如下:
_____![]() +_______CO
+_______CO![]() +___H2O2→___MnCO3+___□+____OH-+____H2O
+___H2O2→___MnCO3+___□+____OH-+____H2O
补全并配平上述化学反应过程式_____;反应中,过碳酸钠起沉淀剂和_________剂作用;若将 1L 含Mn 2000mg·L-1 的含高锰酸根离子的废水处理至含Mn 1.2mg·L-1,则转移电子数为_____mol(保留 2 位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴是熔点高的金属,可与氯气反应制氯化钴![]() ,氯化钴易潮解,可用于催化剂的制备、氨的吸收等。制备氯化钴的装置如图所示。
,氯化钴易潮解,可用于催化剂的制备、氨的吸收等。制备氯化钴的装置如图所示。
已知:![]() 的氧化性强于
的氧化性强于![]() 。
。
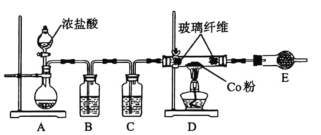
(1)检查![]() 装置气密性的方法:用止水夹夹住
装置气密性的方法:用止水夹夹住![]() 、
、![]() 之间的橡皮管,向分液漏斗中加水,________(将步骤补充完整),证明装置
之间的橡皮管,向分液漏斗中加水,________(将步骤补充完整),证明装置![]() 气密性良好。
气密性良好。
(2)装置![]() 烧瓶中的固体为漂粉精,烧瓶中发生反应的化学方程式________。
烧瓶中的固体为漂粉精,烧瓶中发生反应的化学方程式________。
(3)装置![]() 的洗气瓶中盛放的试剂是________,装置
的洗气瓶中盛放的试剂是________,装置![]() 硬质玻璃管中的玻璃纤维的作用是________。
硬质玻璃管中的玻璃纤维的作用是________。
(4)![]() 中物质的名称________,其作用是________。
中物质的名称________,其作用是________。
(5)钴有多种氧化物,![]() 与浓盐酸反应的离子方程式是________。
与浓盐酸反应的离子方程式是________。
(6)氯化钴溶液与氯化铝溶液类似,直接蒸干不能得到![]() 固体,使氯化亚砜
固体,使氯化亚砜![]() 与
与![]() 混合加热可以得到氯化钴固体,原因是________。
混合加热可以得到氯化钴固体,原因是________。
(7)向氯化钴溶液中加入草酸钠![]() ,生成草酸钴晶体
,生成草酸钴晶体![]() ,将草酸钴晶体在空气中充分加热,将反应生成的气态物质通人澄清石灰水中生成沉淀的质量为的
,将草酸钴晶体在空气中充分加热,将反应生成的气态物质通人澄清石灰水中生成沉淀的质量为的![]() ,剩余固体为钴的某种氧化物,其质量为
,剩余固体为钴的某种氧化物,其质量为![]() ,计算确定钴的氧化物的化学式是________。
,计算确定钴的氧化物的化学式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com