二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等.
Ⅰ.(1)锌-锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.电池的总反应式为Zn(s)+2MnO
2(s)+H
2O(l)═Zn(OH)
2(s)+Mn
2O
3(s).电池的正极反应式为
Ⅱ.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.
①将干电池剖切、分选得到黑色混合物(主要成分为MnO
2)洗涤、过滤、烘干.
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩.
③向上述溶液中加入Na
2CO
3溶液,边加边搅拌,再过滤即可得到碳酸锰.
(2)在第②步中,将上述固体与浓盐酸混合的目的是
(3)有人认为,将第③步中的Na
2CO
3溶液换成NH
4HCO
3溶液,也能达到上述目的,但同时有气体生成.请写出加入NH
4HCO
3溶液时发生的离子反应方程式:
Ⅲ.湿法炼锰即电解硫酸锰溶液法.电解锰的生产过程分为化合浸取、氧化净化及沉淀除杂、产品回收.其生产工艺流程如下:
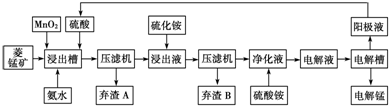
已知:①菱锰矿中主要成份是碳酸锰,主要杂质是Fe
2+、Co
2+、Ni
2+.
②生成氢氧化物的pH如下表:(若某离子浓度小于等于10
-5mol/L,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
③有关难溶氢氧化物和硫化物pK
sp数据(pK
sp=-lgK
sp):
| 难溶物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
(4)菱锰矿粉与硫酸反应的化学方程式是
.
(5)使用氨水的目的是调节pH值在
之间(填pH范围,精确到小数点后1位数字).在“浸出液”中加入(NH
4)
2S(硫化铵)的目的是
(6)电解槽中使用的是惰性电极板,电解反应方程式为
.



 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案 (1)如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同].)
(1)如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同].)