
【题目】对于下图所示实验,下列实验现象预测或操作正确的是

A. 实验甲:逐滴滴加盐酸时,试管中立即产生大量气泡
B. 实验乙:充分振荡后静置,下层溶液为橙红色,上层为无色
C. 实验丙:从饱和食盐水中提取NaCl晶体
D. 装置丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
【答案】D
【解析】
A.先发生碳酸钠与盐酸的反应生成碳酸氢钠;B.上层为氯化铁溶液,为黄色;C.从饱和食盐水中提取NaCl晶体,利用蒸发操作;D.浓硫酸具有脱水性,蔗糖变为C,然后与浓硫酸反应生成二氧化硫,具有还原性,使酸性KMnO4溶液褪色。
A、向等浓度的NaHCO3和Na2CO3的混合液中逐滴滴加稀盐酸时,首先发生的反应为Na2CO3+HCl=NaHCO3+NaCl,一开始不产生气泡,错误;B、充分振荡后静置,下层是溴的四氯化碳溶液为橙红色,上层是三氯化铁溶液为黄色,错误;C、从饱和食盐水中提取NaCl晶体的方法为溶液的蒸发,应用蒸发皿,不应用坩埚,错误;D、将浓硫酸滴入蔗糖中,浓硫酸使蔗糖脱水碳化,浓硫酸还表现强氧化性,还原产物为SO2气体,能使酸性KMnO4溶液颜色逐渐变浅乃至褪去,正确。
故选D。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图①是镁-次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图②是Cr2O72-的工业废水的处理。下列说法正确的是( )

A. 图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图②的电解池中,有0.084g阳极材料参与反应,阴极会有336mL的气体产生(标况)
C. 图①中发生的还原反应是:Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
D. 若图①中3.6g镁溶解产生的电量用以图②废水处理,理论可产生10.7g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属元素,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示。下列说法正确的是( )
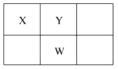
A. Z的最高价氧化物对应的水化物不可能显弱碱性
B. Y的简单阴离子比W的简单阴离子的还原性弱
C. X、W、Q的氢化物均可在Y的单质中燃烧
D. Q的氢化物的水溶液能与W的盐反应得到W的氢化物,说明非金属性Q>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A. 含有4molHCl的浓盐酸与足量MnO2反应,生成1molCl2
B. 78g Na2O2与足量水充分反应时电子转移数为2NA
C. 标准状况下,22.4L SO3中所含的SO3分子数为NA
D. 常温常压下,8g O2所含的质子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:

回答下列问题:
(l)Na2B4O7·10H2O中B的化合价为__________。
(2)Na2B4O7易溶于水,也易发生水解:B4O72-+7H2O![]() 4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取NaBH4,NaBH4被称为有机化学中的“万能还原剂”。
①写出NaBH4的电子式:___________。
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_________(保留两位小数)。
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件下,两瓶气体所含的原子数一定相等的是
①同质量、不同密度的Cl2和CO ②同温度、同体积的H2和 N2
③同体积、同密度的 C2H4和C3H6两种气体④同压强、同体积的 N2和 CO两种气体.
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是

A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色
B. 若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色
D. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列叙述正确的是
A. 若V1L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合后显中性,则V1≤V2
B. 等体积、等物质的量浓度的NaCl溶液中离子总数大于NaClO溶液中离子总数
C. 等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合:![]() <
<![]()
D. 将CH3COOH溶液与NaOH溶液混合,若混合后的溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+),则c(OH-)+c(CH3COO-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修3:物质结构与性质】铝、铁在生活、生产中有着广泛的用途,请回答下列问题。
(1)Fe2+的最外层电子排布式____________。元素Fe与Mn的第三电离能分别为I3(Fe)、I3(Mn),则I3(Fe)______I3(Mn)(填“>”、“<")。
(2)第四周期中,与Al原子未成对电子数相同的金属元素有____种。气态氯化铝的分子组成为(AlCl3)2,其中Al、Cl均达8e-稳定结构,Al原子的杂化方式为__________。根据等电子原理,AlO2-的空间构型为_____。
(3)Fe(CO)5的熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为______,晶体中σ键和π键的数目之比为______。
(4)科学家们发现某些含铁的物质可催化尿素合成肼(N2H4),沸点:N2H4>C2H6的主要原因为____________。
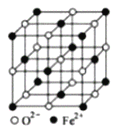
(5)FeO晶体的晶胞如图所示,己知:FeO晶体的密度为ρg/cm3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-最短核间距为______pm(用ρ和NA表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com