
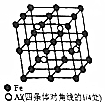
 铝、铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铝、铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: .
. ,C、N、O三种元素的电负性由大到小的顺序为O>N>C.
,C、N、O三种元素的电负性由大到小的顺序为O>N>C.分析 (1)铝是13号元素,主族元素的最外层电子价电子,根据泡利原理和洪特规则画出电子排布图;
(2)亚铁离子和铁氰化钾溶液反应生成蓝色沉淀;等电子体的结构相似,根据氮气的电子式推出CN-的电子式;C、N、O三种元素的电负性依次增大;
(3)与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素是铬;硫酸铜先和氨水反应生成氢氧化铜沉淀,氢氧化铜和氨水继续反应生成铜氨络合物,根据铜氨络合物的化学式确定含有的化学键类型;根据SO42-中心原子含有的共价键个数与孤电子对个数之和确定其空间构型和杂化方式;铜氨络合物在水中的溶解性大于在乙醇中的溶解性;
(4)利用均摊法计算晶胞中Fe、Al原子数目,再计算晶胞的质量,根据ρ=$\frac{m}{V}$计算晶体密度.
解答 解:(1)铝是13号元素,电子排布式为:1s22s22p63s23p1,最外层3个电子是铝的价电子,则价电子排布图为 ,
,
故答案为: ;(2)亚铁离子的特征反应是:亚铁离子和铁氰化钾溶液反应生成蓝色沉淀;等电子体的结构相似,则CN-电子式为
;(2)亚铁离子的特征反应是:亚铁离子和铁氰化钾溶液反应生成蓝色沉淀;等电子体的结构相似,则CN-电子式为 ;C、N、O三种元素的非金属性依次增强,电负性依次增大,电负性依次增大,则由大到小的顺序为O>N>C,
;C、N、O三种元素的非金属性依次增强,电负性依次增大,电负性依次增大,则由大到小的顺序为O>N>C,
故答案为:生成蓝色沉淀; ;O>N>C;
;O>N>C;
(3)铜的价电子排布式为:3d104s1;与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有Cr;
铜离子和氨水先生成氢氧化铜沉淀,氢氧化铜能溶于氨水生成铜氨络合离子,铜氨络合离子中氢原子和氮原子之间存在共价键,铜原子和氮原子之间存在配位键,所以铜氨络合离子中存在共价键和配位键;
SO42-离子中含有4个σ键,没有孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;
铜氨络合物中水中的溶解性大于在乙醇中的溶解性,为析出铜氨络合物,应向溶液中加入乙醇,
故答案为:Cr;共价键和配位键;正四面体,sp3;降低Cu(NH3)4SO4•H2O的溶解度;
(4)晶胞中Al原子数目为4,Fe原子数目为1+8×$\frac{1}{8}$+6×$\frac{1}{2}$+12×$\frac{1}{4}$=8,故该合金的化学式为Fe2Al,晶胞质量为$\frac{4×27+56×8}{{N}_{A}}$g,若晶胞的边长为a nm,则合金的密度为$\frac{4×27+56×8}{{N}_{A}}$g÷(a×10-7cm)3=$\frac{5.56×1{0}^{23}}{{a}^{3}{N}_{A}}$g•cm-3,
故答案为:Fe2Al;$\frac{5.56×1{0}^{23}}{{a}^{3}{N}_{A}}$.
点评 本题是对物质结构的考查,涉及价电子排布图、电负性、杂化理论、分子构型、配合物、晶胞计算等,综合性强,但解题具有较强的方法性和规律性,注意多总结和积累.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | H+、Ca2+、Cl-、CO32- | B. | Cl-、ClO-、K+、H+ | ||
| C. | Na+、Fe3+、SO42-、OH- | D. | Na+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将钢片插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| B. | 稀硫酸与Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加醋酸:SiO32-+2H+=H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
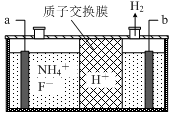 在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.
在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +CO2↑
+CO2↑ $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$ +H2O
+H2O $→_{(Ⅱ)H+}^{(Ⅰ)_{10}%NaOH;Cu}$
$→_{(Ⅱ)H+}^{(Ⅰ)_{10}%NaOH;Cu}$
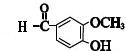 +CH3COCH2COCH3$→_{△}^{NaOH(aq)}$
+CH3COCH2COCH3$→_{△}^{NaOH(aq)}$ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
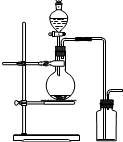
| A. | 氯酸钾溶液与二氧化锰反应制氧气 | B. | 浓氨水与氢氧化钙固体制氨气 | ||
| C. | 乙醇和浓硫酸(170℃)制乙烯 | D. | 铜和浓硝酸制二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.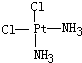 、
、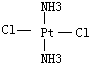 .
.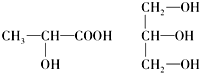
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com