
【题目】以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如图: 
回答下列问题:
(1)写H2O2的作用是并写出该步骤中发生的主要反应的离子方程式;
(2)如何检验中和反应后滤渣中阳离子已完全除尽?;
(3)写出工业制备金属铝的化学方程式 .
【答案】
(1)氧化亚铁离子为铁离子;2Fe2++H2O2+2H+═2Fe3++2H2O
(2)取少量中和后的溶液,滴加KSCN溶液,若溶液不变红,则已完全除去;若溶液变红,则未除尽
(3)2Al2O3 ![]() 4Al+3O2↑
4Al+3O2↑
【解析】解:Al(OH)3、H2SO4发生反应为2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O;工业(NH4)2SO4(含FeSO4)溶于水,然后向溶液中加入双氧水,双氧水具有氧化性、硫酸亚铁具有还原性,二者发生氧化还原反应生成铁离子和水,离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,将得到的溶液中加入氨水,调节溶液的pH,使铁离子转化为Fe(OH)3沉淀,然后过滤得到滤渣;将滤液加入硫酸铝溶液中,通过分离得到固体NH4Al(SO4)212H2O,加热固体NH4Al(SO4)212H2O,该物质分解生成M和含铝物质,(1)双氧水和亚铁离子发生氧化还原反应生成铁离子和水,过氧化氢作用是氧化亚铁离子生成铁离子,便于除去,离子反应方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,
所以答案是:氧化亚铁离子为铁离子,2Fe2++H2O2+2H+═2Fe3++2H2O;(2)中和液中的杂质离子是铁离子,铁离子用KSCN溶液检验,其检验方法为取少量中和后的溶液,滴加KSCN溶液,若溶液不变红,则已完全除去;若溶液变红,则未除尽,
所以答案是:取少量中和后的溶液,滴加KSCN溶液,若溶液不变红,则已完全除去;若溶液变红,则未除尽;(3)工业制备金属铝的化学方程式为:2Al2O3 ![]() 4Al+3O2↑,
4Al+3O2↑,
所以答案是:2Al2O3 ![]() 4Al+3O2↑;
4Al+3O2↑;


科目:高中化学 来源: 题型:
【题目】室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体充分接触(如图),容器内的压强由大到小的顺序是( )
编号 | ① | ② | ③ | ④ |
气体M | H2S | NH3 | HI | NO |
气体N | SO2 | HCl | Cl2 | O2 |
![]()
A.③=④>①>②
B.③>④>①>②
C.④>③>②>①
D.④>③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( ) 
A.图Ⅰ配制1mol/L NaCl溶液定容操作
B.图Ⅱa口进气可收集Cl2、CO2等气体
C.图Ⅲ探究NaHCO3的热稳定性
D.图Ⅳ蒸发结晶获得氯化钠晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物的结构简式为  ,用等物质的量的该有机物分别与Na、NaOH,NaHCO3反应时,则消耗Na、NaOH,NaHCO3的物质的量之比为( )
,用等物质的量的该有机物分别与Na、NaOH,NaHCO3反应时,则消耗Na、NaOH,NaHCO3的物质的量之比为( )
A.3:2:1
B.3:1:1
C.1:1:1
D.3:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有100mL含Cu2+、Al3+、NH4+、H+、Cl-的溶液,向该溶液中逐滴加入2.5mol·L-1NaOH溶液,所加NaOH 溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示: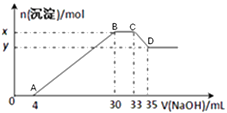
(1)B点的沉淀物的化学式为。
(2)原溶液中Cu2+的物质的量为 , 原溶液中Cl-物质的量浓度为。
(3)原溶液的pH= , x-y= 。
(4)经过滤得到D点的沉淀物,并多次用蒸馏水洗涤沉淀,判断沉淀是否洗涤干净的方法是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是( )
A. 灼热的木炭与CO2反应B. 锌粒与稀硫酸的反应
C. 碳酸钙的高温分解D. Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表格中的各种情况,可以用如图的曲线表示的是( )
反 应 | 纵坐标 | 甲 | 乙 | |
A | 相同质量的氨,在同一容器中 | 氨气的转化率 | 500℃ | 400℃ |
B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
C | 向温度和压强都相同的甲乙两容器中分别投入体积比1:3的N2、H2(N2+3H2═2NH3) | 氨气的物质的量 | 反应过程中保持恒温恒容 | 反 应过程中保持恒温恒压 |
D | 2molSO2和1molO2 , 在相同温度下 | SO3 的浓度 | 2个大气压 | 10个大气压 |
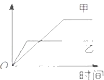
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.100molL﹣1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写) .
(2)上述B步骤操作的目的是 .
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果(填“偏高“、“偏低”或“不变”).
(4)判断到达滴定终点的实验现象是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com