
四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的总电子数多1;C元素的原子最外层电子数是次外层的3倍; D是形成化合物种类最多的元素。
(1)A、D形成的某种化合物甲是一种重要的化工产品,可用作水果和蔬菜的催熟剂,甲分子中σ键和π键数目之比为________;写出由甲制高聚物的反应方程式 。
(2)A、C形成的某种化合物乙分子中含非极性共价键,乙分子属于________(“极性分子”或“非极性分子”);其电子式________;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式 。
(3)写出B的基态原子电子排布图为 。与PH3相比,BA3易液化的主要原因是___________________________________;
(4)笑气(B2C)是一种麻醉剂,有关理论认为B2C与DC2分子具有相似的结构。故B2C的空间构型是________,其为________(填“极性”或“非极性”)分子 。
(1) 5: 1 n CH2=CH2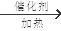
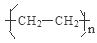 (2)极性分子;
(2)极性分子;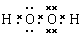 ;2 Fe2+ +2H2O2+2H+=2Fe3++2H2O (3)
;2 Fe2+ +2H2O2+2H+=2Fe3++2H2O (3)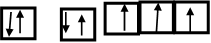 ;NH3中有氢键。(4) 直线型 ,非极性分子
;NH3中有氢键。(4) 直线型 ,非极性分子
解析试题分析:根据题意可知:A的H;B是N;C是O;D是 C。(1)H、C形成的某种化合物甲C2H4是一种重要的化工产品,可用作水果和蔬菜的催熟剂,在C2H4分子中σ键是5个和π键数目是1个,所以个数之比为5:1 。由乙烯制高聚物聚乙烯的反应方程式为n CH2=CH2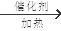
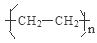 。(2)A、C形成的某种化合物乙分子中含非极性共价键,则乙分子是H2O2,由于各个化学键的空间排列不对称,所以属于极性分子,其电子式是
。(2)A、C形成的某种化合物乙分子中含非极性共价键,则乙分子是H2O2,由于各个化学键的空间排列不对称,所以属于极性分子,其电子式是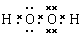 。将H2O2加入浅绿色酸性FeCl2溶液中,溶液变为棕黄色,该反应的离子方程式是2 Fe2+ +2H2O2+2H+=2Fe3++2H2O。(3)B原子的基态原子电子排布图为
。将H2O2加入浅绿色酸性FeCl2溶液中,溶液变为棕黄色,该反应的离子方程式是2 Fe2+ +2H2O2+2H+=2Fe3++2H2O。(3)B原子的基态原子电子排布图为 。与PH3相比,NH3易液化的主要原因是因为在分子之间存在氢键,增加了分子之间的相互作用力。(4)笑气(N2O)是一种麻醉剂,有关理论认为N2O 与CO2分子具有相似的结构。因为CO2分子是直线型分子,故B2C的空间构型是直线型。由于各个化学键的空间排列的对称的所以该分子为非极性分子。
。与PH3相比,NH3易液化的主要原因是因为在分子之间存在氢键,增加了分子之间的相互作用力。(4)笑气(N2O)是一种麻醉剂,有关理论认为N2O 与CO2分子具有相似的结构。因为CO2分子是直线型分子,故B2C的空间构型是直线型。由于各个化学键的空间排列的对称的所以该分子为非极性分子。
考点:考查元素的推断、物质的结构、性质及化学方程式的书写的知识。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:填空题
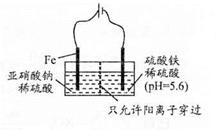
利用15N可以测定亚硝酸盐对地下水质的污染情况。
(1)下列说法正确的是___。
| A.14N与15N为同种核素 |
| B.14N的第一电离能小于14C |
| C.15NH3与14NH3均能形成分子间氢键 |
| D.CH315NH2与CH3CH214NH2互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分)W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示。常温下0.01mol/L-1丙溶液
PH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图II所示。请回答下列问题: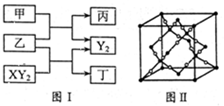
(1)甲与乙反应的化学方程式是______。
(2)甲的中心原子杂化轨道类型为_____;
XY2分子中,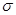 键与π键的数目之比为_________;
键与π键的数目之比为_________;
XY2原子晶体的1个晶胞中含有_______个原子。
W、X、Y、Z四种元素电负性由大到小的顺序是_______(用元素符号表示)。
工业上用氯气与潮湿的丁反应制备次氯酸的酸酐(棕黄色气体),同时生成小苏打和食盐混合物,反应的化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(13分)[化学——物质结构与性质]由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为 。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因: 。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于 晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4 + 2 (HB=NH)3 + 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是 。(填标号)
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |
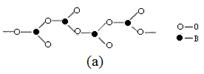
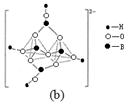
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)
亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂
(1)第一电离能:N ___O(填“<”、“>”或“=”);NO2-的空间构型为____
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,该反应的化学方程式为____
(3)亚硝酸钠是亚硝酸的钠盐。HNO2的结构如图所示,则HNO2分子中有___个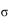 键:
键:
HNO2的酸性比HN03弱是因为_____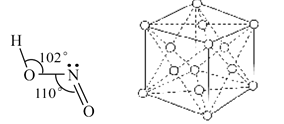
(4)亚硝基钻钠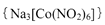 是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的
是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的 沉淀,可用于检验K+的存在。
沉淀,可用于检验K+的存在。
①基态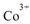 的价层电子排布图为_____
的价层电子排布图为_____
②用亚硝酸钻钠检验K+的离子方程式是
③金属钴的堆积方式如图所示,若一个钴原子的半径为r,,则晶胞的体积V(晶胞)=__
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:
试回答以下问题
(1)B在周期表中的位置是 。B的氢化物与E的氢化物比较,沸点较高的是 (填化学式),在水中溶解度较大的是 (填化学式)
(2)写出D3B与甲反应所得溶液呈 (填“酸性”、“碱性”或“中性”),原因是(用化学方程式表示) 。
(3)写出丙的电子式为 。说明丙的水溶液在放置过程中其酸性会增强的原因(用离子方程式表示) 。
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性。可用来鉴别丁和氯化钠的试剂有
A.氢碘酸和淀粉的混合液 B.AgNO3溶液
C.甲基橙试剂 D.稀硫酸
(5)将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深绿色溶液,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【物质结构与性质】
碳、氮、氧是构成生命物质的三种主要元素。
(1)碳、氮、中,原子核外电子未成对电子数最多的是 (用元素符号表示)。
(2)已知CN-与N2结构相似,则HCN分子中σ键与π键数目之比为 。
(3)H2O2分子中氧原子的杂化方式为 。
(4)与NO2+互为等电子体的微粒有 、 (举2例),NO3-的空间构型是 。
(5)已知元素A的氧化物的晶胞结构如图所示,则该氧化物的化学式为 。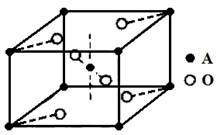
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学生在做元素性质与原子结构的关系的实验时,设计了一套实验方案,并记录了有关的实验现象。请帮助该学生整理并完成实验报告。
(1)实验目的。
探究同一主族元素性质的递变规律。
(2)实验用品。
仪器:试管、胶头滴管。
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在下表横线中填写相关内容)。
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈________色 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈________色 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列对σ键的认识不正确的是
| A.ss σ键与sp σ键的对称性相同 |
| B.烯烃分子中的碳碳双键的键能是碳碳单键键能的二倍 |
| C.分子中含有共价键,则至少含有一个σ键 |
| D.含有π键的化合物与只含σ键的化合物的化学性质不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com