
能用Cu2++2OH-![]() Cu(OH)2↓离子方程式表示的化学反应是( )
Cu(OH)2↓离子方程式表示的化学反应是( )
A.CuSO4溶液与Ba(OH)2溶液反应
B.CuCl2溶液与NaOH溶液反应
C.CuCO3与NaOH溶液反应
D.CuCl2溶液与AgNO3溶液反应
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
 某同学用胆矾晶体(CuSO4?5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题
某同学用胆矾晶体(CuSO4?5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题| 鉴别对象 | 所选试剂 | 反应的离子方程式 |
| Cu2+ | NaOH溶液 NaOH溶液 |
Cu2++2OH-=Cu(OH)2↓ Cu2++2OH-=Cu(OH)2↓ |
| SO42- | 稀盐酸,BaCl2溶液 稀盐酸,BaCl2溶液 |
Ba2++SO42-=BaSO4↓ Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 9n |
| 4m |
| 9n |
| 4m |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
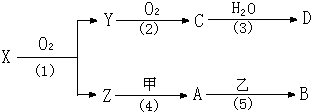
| ||
| 高温高压 |
| ||
| 高温高压 |
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com