
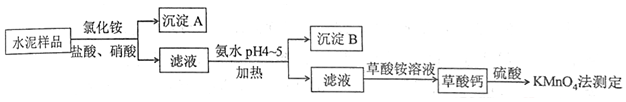
| 实验序号 | 1 | 2 | 3 |
| 消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
分析 (1)配制硝酸银标准溶液时,所使用的仪器出需烧杯和玻璃棒外还有250mL(棕色)容量瓶及定容时需要的胶头滴管;
(2)硝酸银见光分解;
(3)滴定应注意防止铁离子的水解,影响滴定结果;
(4)铁离子与碘离子发生氧化还原反应;
(5)根据所提供的三组数据,第一组数据误差较大,应舍去,二、三组数据取平均值即可,所以所消耗的NH4SCN溶液平均体积为10.00mL,
结合c(AgNO3)×V(AgNO3)=c(NH4SCN)×V(NH4SCN)+c(I-)×V(I-)计算;
(6)装入NH4SCN标准溶液,应避免浓度降低,应用NH4SCN标准溶液进行润洗;
(7)反应的原理为c(AgNO3)×V(AgNO3)=c(NH4SCN)×V(NH4SCN)+c(I-)×V(I-),如操作导致c(NH4SCN)×V(NH4SCN)偏小,则测定结果偏大,以此解答该题.
解答 解:(1)配制硝酸银标准溶液时,所使用的仪器出需烧杯和玻璃棒外还有250mL(棕色)容量瓶及定容时需要的胶头滴管,
故答案为:250 mL(棕色)容量瓶、胶头滴管;
(2)硝酸银标准溶液放在棕色试剂瓶中避光保存是因为硝酸银见光分解,故答案为:避免AgNO3见光分解;
(3)滴定应在pH<0.5的条件下进行,原因是抑制铁离子的水解,防止因铁离子的水解而影响滴定终点的判断,
故答案为:防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解);
(4)b和c两步操作不能颠倒,若颠倒,铁离子与碘离子发生氧化还原反应,指示剂耗尽则无法判断滴定终点,
故答案为:否(或不能);若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点;
(5)根据所提供的三组数据,第一组数据误差较大,应舍去,二、三组数据取平均值即可,所以所消耗的NH4SCN溶液平均体积为10.00mL,
n(AgNO3)=25.00×10-3L×0.1000mol•L-1=2.5×10-3mol,n(NH4SCN)=0.1000mol•L-1×10.00×10-3L=1.00×10-3mol,
则c(I-)×0.25L=2.5×10-3mol-1.00×10-3mol,c(I-)=0.0600mol•L-1,
故答案为:10.00;0.0600;
(6)装入NH4SCN标准溶液,应避免浓度降低,应用NH4SCN标准溶液进行润洗,故答案为:用NH4SCN标准溶液进行润洗;
(7)反应的原理为c(AgNO3)×V(AgNO3)=c(NH4SCN)×V(NH4SCN)+c(I-)×V(I-),
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则导致溶质的物质的量减小,浓度偏低,则n(NH4SCN)偏小,测定c(I-)偏大,
故答案为:偏高;
①若在滴定终点读取滴定管刻度时,俯视标准液液面,造成读数偏小,则n(NH4SCN)偏小,测定c(I-)偏大,
故答案为:偏高.
点评 本题为2017年天津考题,涉及物质含量的测定,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验的操作方法和注意事项,把握反应的原理和误差分析的角度,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:d>c>b>a | B. | 4种元素中b的金属性最强 | ||
| C. | c的氧化物的水化物是强碱 | D. | d单质的氧化性比a单质的氧化性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
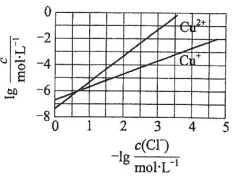 在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-.根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-.根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )| A. | Ksp(CuCl)的数量级为10-7 | |
| B. | 除Cl-反应为Cu+Cu2++2Cl-=2CuCl | |
| C. | 加入Cu越多,Cu+浓度越高,除Cl-效果越好 | |
| D. | 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
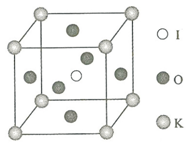 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | W的最高价氧化物的水化物是一种弱碱 | |
| C. | Y的单质的氧化性比Z的强 | |
| D. | X、Y、Z 三种元素可以组成共价化合物和离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

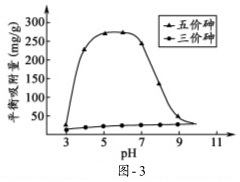
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热蒸发皿和烧杯必须垫石棉网 | |
| B. | 除去乙醇中的乙酸,加入NaOH溶液后分液 | |
| C. | 将硫酸铜溶液蒸发浓缩、冷却结晶得到CuSO4•5H2O | |
| D. | 配制1 L 0.1mol•L-1NaCl溶液的实验中,用托盘天平称取5.85g NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的含氧酸的酸性比Z的含氧酸的酸性强 | |
| B. | 原子半径:X>Y>Z>W | |
| C. | W的气态氢化物的稳定性小于Y的气态氢化物的稳定性 | |
| D. | 若W与X原子序数差为5,则形成化合物的化学式为X3W2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com