
 CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用.
CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用.分析 (1)相同温度下,酸的浓度越小其电离程度越大,醋酸和碱反应消耗碱的物质的量与酸的物质的量成正比;
醋酸钠是强碱弱酸盐,其溶液呈碱性,再结合电荷守恒判断钠离子和醋酸根离子浓度大小;
(2)根据③中物料守恒计算醋酸浓度,再根据pH=pKa-lgc(CH3COO-)/lgc(CH3COOH)计算电离平衡常数.
解答 解:(1)相同温度下,酸的浓度越小其电离程度越大,所以pH=3醋酸的浓度大于pH=4醋酸浓度的10倍,100mL pH=3的CH3COOH溶液和1L pH=4的CH3COOH溶液,前者的物质的量大于后者,醋酸和碱反应消耗碱的物质的量与酸的物质的量成正比,所以消耗氢氧化钠体积V1>V2;
醋酸钠是强碱弱酸盐,其溶液呈碱性,则c(OH-)>c(H+),再结合电荷守恒得c(Na+)>C(CH3COO-),醋酸根离子水解程度很小,所以溶液中离子浓度大小顺序是c(Na+)>C(CH3COO-)>c(OH-)>c(H+),
故答案为:>;c(Na+)>C(CH3COO-)>c(OH-)>c(H+);
(2)根据③中物料守恒得醋酸浓度=$\frac{0.02012L×0.1mol/L}{0.020L}$=0.1006mol/L,A为缓冲溶液,pH=pKa-lgc(CH3COO-)/lgc(CH3COOH),5=pKa-lg2,10-5=$\frac{{K}_{a}}{2}$,Ka=2×10-5,故答案为:2×10-5;0.1006 mol/L.
点评 本题考查了弱电解质的电离,根据弱电解质的电离平衡特点、酸碱混合溶液酸碱性等知识点来分析解答,灵活运用微粒间关系找出这几个常数之间的关系式是解本题关键,侧重考查学生分析计算能力,题目难度中等.


科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )
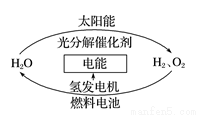
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.2 mol 液态H2O具有的总能量低于2 mol H2和1 mol O2的能量
D.氢气不易贮存和运输,无开发利用价值
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种溶液中的KW相同,由水电离出的c(H+):①=②=③=④ | |
| B. | 取体积相同的溶液①、②、③分别与足量铝粉反应,生成H2的量:①最少 | |
| C. | 将等体积的四种溶液分别稀释100倍,所得溶液的pH:③>④>②>① | |
| D. | 常温下,将②和③等体积混合:c(CH3COO-)-c(Na+)=c(H+)-c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10 | 0.5 | 20.6 |
| 第二次 | 10 | 4.2 | 24.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水中铵根离子和氢氧化钠溶液中钠离子浓度相等 | |
| B. | 温度下降10℃,两溶液的pH均不变 | |
| C. | 氨水和氢氧化钠溶液的浓度相等 | |
| D. | 分别与等浓度的盐酸反应,氨水消耗盐酸的体积与氢氧化钠消耗盐酸的体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com