
【题目】如图是元素周期表的一部分:
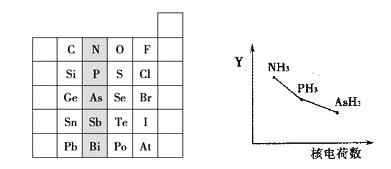
⑴ 阴影部分元素的外围电子排布式的通式为_________。Sb的元素名称为________。基态P原子中,电子占据的最高能级符号为______,该能层具有的原子轨道数为______。
⑵ 氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如上右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
A.稳定性B.沸点C.R—H键能D.分子间作用力
⑶ 某种新型储氧材料的理论结构模型如下左图所示,图中虚线框内碳原子的杂化轨道类型有____________种。

⑷ CN-和Fe2+、Fe3+及K+能形成一种蓝色配位化合物普鲁士蓝。上右图是该物质的的结构单元(K+未标出),该图是普鲁士蓝的晶胞吗?_______ (填“是”或“不是”),平均每个晶胞中含有______个K+。

⑸磷酸盐与硅酸盐之间具有几何形态的相似性。如多磷酸盐与多硅酸盐一样,也是通过四面体单元通过共用顶角氧离子形成岛状、链状、层状、骨架网状等结构型式。不同的是多硅酸盐中是{SiO4}四面体,多磷酸盐中是{PO4}四面体。右图为一种无限长单链结构的多磷酸根,该多磷酸根的化学式为___________。
【答案】ns2np3 锑 3P 9 AC 3 不是 ![]() (PO3)nn-或PO3-
(PO3)nn-或PO3-
【解析】
(1)阴影部分元素处于ⅤA族,最外层有5个电子,其外围电子排布的通式为ns2np3,P核外还有3个电子层,则电子占据的最高层符号为M,M层还有1个s轨道、3个p轨道和5个d轨道,总共还有9个轨道,电子占有的最高能级为3p;Sb元素为锑,答案为ns2np3 锑 3P 9;
(2)A.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可以知道,非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低, A选项正确;B.因为氨气分子间存在氢键,因此氨气的沸点最高,AsH3的相对分子质量大于PH3,AsH3沸点较PH3高,故B错误;C.非金属性越强与氢元素形成的共价键越强,键能越大,因此键能随原子序数的增大而减小,所以C选项是正确的;D.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,故D错误;答案为AC;
(3)C原子的杂化构型可以通过周围有几个原子来判断,在框图中C原子周边的原子数有3、4、2,共3种情况,球的部分基本上所有的C原子周围有3个C原子,为sp2杂化,在球和链相连的C原子其周围有4个C原子,sp3杂化,链上的C周边有2个C原子,sp杂化,答案为3。
(4) 普鲁士蓝的化学式为Fe4[Fe(CN)6]3,Fe2+和Fe3+的个数相等为![]() ,CN-的个数为
,CN-的个数为![]() ,它们的个数比不符合普鲁士蓝的化学式。在晶胞中电荷守恒,Fe2+和Fe3+所带的正电荷
,它们的个数比不符合普鲁士蓝的化学式。在晶胞中电荷守恒,Fe2+和Fe3+所带的正电荷![]() ,而CN-带的负电荷为3,K+所带的电荷为
,而CN-带的负电荷为3,K+所带的电荷为![]() ,每个晶胞中含有
,每个晶胞中含有![]() 个K+,答案为不是
个K+,答案为不是 ![]() ;
;
(5)根据图片知,每个三角锥结构中P原子是1个,O原子个数是![]() 个,所以P原子和氧原子个数之比1:3,3个O原子带6个单位负电荷,磷酸盐,P的化合价为+5,所以形成离子为(PO3)nn-或PO3-。
个,所以P原子和氧原子个数之比1:3,3个O原子带6个单位负电荷,磷酸盐,P的化合价为+5,所以形成离子为(PO3)nn-或PO3-。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】NaClO2常用来漂白织物,其漂白能力是漂白粉的4~5倍NaClO2也是一种重要的杀菌消毒剂。工业上生产NaClO2的一种工艺流程如下图所示:

(1)ClO2发生器中的产品之一是NaHSO4,在该发生器中所发生反应的离子方程式为___________。
(2)反应结束后,向ClO2发生器中通入一定量空气,目的是___________。
(3)吸收器中发生反应的化学方程式为___________。吸收器中要用冷的NaOH溶液和H2O2溶液吸收CO2,原因是___________。
(4)将ClO2通入食盐水中,用情性电极电解,也可以制得NaClO2产品。阳极的电解产物是___________(填化学式),阴极的电极反应式为___________。
(5)相同条件下,1 mol NaClO2与___________gCl2的氧化能力相当。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的五种尾气吸收装置中,适合吸收极易溶于水的气体,且能防止产生倒吸现象(溶液进入气体发生装置中)的是 ( )

A.②④⑤B.①②④C.①②③D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
(2)某温度下,若把1 mol N2与3 mol H2置于体积为1L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为1/3,则该温度下反应的K的计算式=________(用分数表示)。能说明该反应达到化学平衡状态的是________(填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。

(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用A和B为原料合成E的路线如下。已知B的分子式为C2H2O3 ,可发生银镜反应且具有酸性,回答下列问题:

(1)E中含氧官能团的名称为_____________________。
(2)A的名称为_________。写出B 发生银镜反应的化学方程式_________________。
(3)C→D反应的化学方程式为____________,D→E的反应类型是_____________。
(4)写出符合下列条件的C的所有同分异构体(不考虑立体异构)的结构简式___________。
①属于羧酸类芳香化合物 ②核磁共振氢谱中出现4组峰
(5)设计由乙酸为起始原料制备OHC-COOH 的合成路线(无机原料任选):
CH3COOH ClCH2COOH ________________________________________。
ClCH2COOH ________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 风力、化石燃料、太阳能都是一次能源B. 需要加热才能发生的反应都是吸热反应
C. 断开1molC-H键要放出一定的能量D. 燃煤发电是将化学能直接转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋酸钠( NaBiO3 )是一种难溶于水的强氧化剂,在钢铁工业中常用作锰元素的分析测定。某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3,SiO2等杂质)制备铋酸钠,其流程如下:

请回答下列问题:
(1)为了提高“浸取”中原料的浸出率,可以采取的措施是_________________(写一种即可) 。
(2)“浸取”时通常加入FeCl3溶液和浓盐酸,向其中加入过量浓盐酸的目的是_____,“滤渣”的成份是____________(填化学式)。
(3)“沉淀”反应的离子方程式为__________________________________________________;
(4)“沉淀”操作时,用氨水调节pH至6,通过计算说明,此时溶液中的Bi3+是否完全沉淀:____________________(已知:Bi(OH)3的溶度积Ksp=3×10-32) 。
(5)“焙烧”除了采用最佳的质量比、合适的温度外,你认为还需要控制的条件是________。
(6)已知,在酸性溶液中NaBiO3将Mn2+氧化为MnO4-。请出该反应的离子方程式:__________。
(7)某辉铋矿中铋元素的质量分数为20.90%,若100吨该辉铋矿完全用于生产,共得到25.00吨NaBiO3,则产率是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去甲烷中混有的乙烯,可依次通过盛有下列哪一组试剂的洗气瓶( )
A. 澄清石灰水、浓硫酸B. 酸性KMnO4溶液、浓硫酸
C. 溴水、浓硫酸D. 浓硫酸、NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com