
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
分析 ①铜铝混合物中只有Al能和稀盐酸反应,根据生成气体体积可以计算Al的质量;
②铜铝混合物中只有Al能和NaOH溶液反应,剩余的固体是Cu,溶解的固体为Al;
③铜铝混合物在加热条件下都可以和氧气反应生成氧化物,根据混合物的质量、反应后固体增加的质量可以计算出Al的质量;
④铁铝混合物都能和稀盐酸反应生成氢气,根据混合物的质量及生成氢气的体积列方程式计算出Al的质量.
解答 解:①铜铝混合物中只有Al能和稀盐酸反应生成氢气,根据生成气体体积与Al的关系式计算Al的质量,从而计算Al的质量分数,故正确;
②铜铝混合物中只有Al能和NaOH溶液反应,剩余的固体是Cu,溶解的固体为Al,从而计算Al的质量分数,故正确;
③铜铝混合物在加热条件下都可以和氧气反应生成氧化物,根据混合物的质量、反应后固体增加的质量可以计算出Al的质量,从而计算出铝的质量分数,故正确;
④铁铝混合物都能和稀盐酸反应生成氢气,根据混合物的质量及生成氢气的体积列方程式计算出Al的质量,从而计算出铝的质量分数,故正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生分析判断及对元素化合物性质的理解和掌握,明确元素化合物性质是解本题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
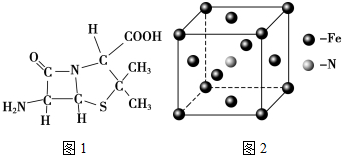
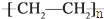 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下硫的氧化物都是气体,通入水中都形成强酸 | |
| B. | 将FeCl3滴入饱和H2S溶液中,溶液的pH降低 | |
| C. | 将CO2通入CaSO4溶液中,无明显现象 | |
| D. | 充分利用含硫矿物,既可实现资源的有效利用,还可减轻酸雨污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| B. | 2.24 L CO2中含有的原子数为0.3×6.02×1023 | |
| C. | 200 mL 5 mol•L-1 Na2CO3溶液中,含6.02×1023个CO32- | |
| D. | 4.5gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿矾一FeSO4•7H2O | B. | 芒硝一Na2SO4•10H2O | ||
| C. | 明矾一Al(SO4)3•12H2O | D. | 胆矾一CuSO4•5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为NO2+NO3--e-═N2O5.若生成1molY,则需要消耗标准状况下氧气的体积为5.6L.
(1)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为NO2+NO3--e-═N2O5.若生成1molY,则需要消耗标准状况下氧气的体积为5.6L.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
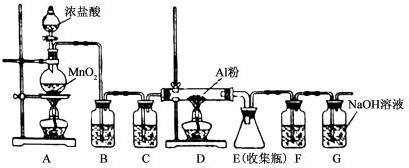
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
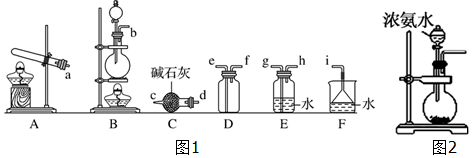
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com