
ПтЛДёцМе»эПаН¬өДГЬұХИЭЖчЦР·ЦұрідИЛТ»¶ЁБҝөДSO2әНO2Ј¬ҝӘКј·ҙУҰКЗЈ¬°ҙХэ·ҙУҰЛЩВКУЙҙуөҪРЎөДЛіРтЕЕБРХэИ·өДКЗ
јЧЈәФЪ 500ЎжКұЈ¬SO2әНO2ёч 10 mol ·ҙУҰ
ТТЈәФЪ500ЎжКұЈ¬УГV2O5ЧчҙЯ»ҜјБЈ¬SO2әНO2ёч10 mol·ҙУҰ
ұыЈәФЪ450ЎжКұЈ¬8 mol SO2әН5 mol O2·ҙУҰ
¶ЎЈәФЪ500ЎжКұЈ¬8 mol SO2әН5 mol O2·ҙУҰ
AЈ®ТТЎўјЧЎў¶ЎЎўұы B Ј®ТТЎўЙкЎўұыЎў¶Ў
CЈ®јЧЎўТТЎўұыЎў¶Ў D Ј®¶ЎЎўұыЎўТТЎўјЧ
 ҝӘРДҝмАЦјЩЖЪЧчТөКојЩЧчТөОч°Ііц°жЙзПөБРҙр°ё
ҝӘРДҝмАЦјЩЖЪЧчТөКојЩЧчТөОч°Ііц°жЙзПөБРҙр°ё ГыМвСөБ·ПөБРҙр°ё
ГыМвСөБ·ПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмәюұұКЎҫЈГЕКРёЯ¶юЙПС§ЖЪЖЪД©ЦКБҝјмІв»ҜС§КФҫнЈЁҪвОц°жЈ© МвРНЈәСЎФсМв
ТСЦӘCuSO4ИЬТә·ЦұрУлNa2CO3ИЬТәЎўNa2SИЬТәөД·ҙУҰЗйҝцИзПВЈә
ЈЁ1Ј©CuSO4+Na2CO3ЈәCu2++CO32Јӯ+H2O=Cu(OH)2Ўэ+CO2Ўь
ЈЁ2Ј©CuSO4+Na2SЈә Cu2++S2-=CuSЎэ
ПВБРјёЦЦОпЦКөДИЬҪв¶ИҙуРЎөДұИҪПЦРЈ¬ХэИ·өДКЗ
AЈ®CuSЈјCu(OH)2ЈјCuCO3 BЈ®CuCO3ЈјCu(OH)2ЈјЈГuS
CЈ®CuSЈјCuCO3ЈјCu(OH)2 DЈ®Cu(OH)2ЈјЈГuCO3ЈјCuS
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмәюұұКЎҫЈЦЭКРІҝ·ЦПШКРёЯ¶юЙПС§ЖЪЖЪД©ҝјКФ»ҜС§КФҫнЈЁҪвОц°жЈ© МвРНЈәСЎФсМв
ТАҫЭјЧЎўТТЎўұыИэНј»ШҙрПВБРОКМвЈә
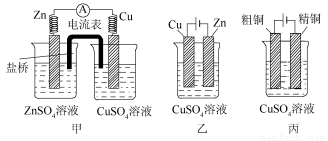
(1)јЧЧ°ЦГОӘ__________Ј¬ТТЧ°ЦГОӘ__________Ј¬ұыЧ°ЦГОӘ__________ЎЈ
(2)јЧЎўТТЧ°ЦГЦРЈ¬Рҝј«ЙП·Цұр·ўЙъ__________·ҙУҰЎў__________·ҙУҰЎЈ
(3)ТТЧ°ЦГЦРЈ¬Cu2Ј«ЕЁ¶И__________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмәюұұКЎёЯ¶юЙПС§ЖЪЖЪД©ҝјКФ»ҜС§КФҫнЈЁҪвОц°жЈ© МвРНЈәМоҝХМв
ЈЁ1Ј©ИзНјКЗјЧНйИјБПөзіШФӯАнКҫТвНјЈ¬»ШҙрПВБРОКМвЈә
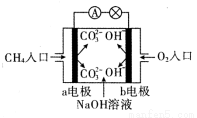
ўЩөзіШөДёәј«КЗ ЈЁМоЎ°aЎұ»тЎ°bЎұ Ј©ј«Ј¬ёГј«өДөзј«·ҙУҰКҪКЗ ЎЈ
ўЪ өзіШ№ӨЧчТ»¶ОКұјдәуөзҪвЦКИЬТәөДpH ЈЁМоЎ°ФцҙуЎұЎўЎ°јхРЎЎұ»тЎ°І»ұдЎұЈ©ЎЈ
ЈЁ2Ј©АыУГјЧНйИјБПөзіШј°ПВНјЛщКҫөДЧ°ЦГНкіЙөзҪвұҘәНКіСОЛ®өДКөСйЈ¬ТӘЗуІв¶ЁІъЙъөДЗвЖшөДМе»эЈ¬ІўјмСйВИЖшөДСх»ҜРФЎЈ
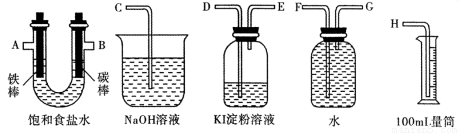
ўЩЙијЖЙПКцКөСйЧ°ЦГКұЈ¬ёчҪУҝЪөДХэИ·Б¬ҪУЛіРтОӘЈә ҪУ Ўў ҪУ A Ўў B ҪУ Ўў ҪУ ЎЈ
ўЪКөСйЦРЈ¬ФЪКўУР KI өн·ЫИЬТәөДИЭЖчЦР·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪОӘ ЎЈ
ўЫТСЦӘұҘәНКіСОЛ®50mLЈ¬ДіКұҝМІвөГ H2Ме»эОӘ56mL ЈЁұкЧјЧҙҝцЈ©Ј¬ҙЛКұИЬТә pH ФјОӘ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмәюұұКЎёЯ¶юЙПС§ЖЪЖЪД©ҝјКФ»ҜС§КФҫнЈЁҪвОц°жЈ© МвРНЈәСЎФсМв
ТСЦӘЈә 2H2(g) + O2(g) = 2H2O (l) ЎчHЈҪ©Ө571.6 kJ/molЈ¬
CO(g)Ј«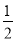 O2(g ) = CO2( g ) ЎчHЈҪ©Ө283.0 kJ / mol ЎЈ
O2(g ) = CO2( g ) ЎчHЈҪ©Ө283.0 kJ / mol ЎЈ
ДіH2әНCOөД»мәПЖшМеНкИ«ИјЙХКұ·Еіц113.74kJ ИИБҝЈ¬Н¬КұЙъіЙ 3.6 gТәМ¬Л®Ј¬ФтФӯ»мәПЖшМеЦРH2әНCOөДОпЦКөДБҝЦ®ұИОӘ
A. 2:1 B. 1:2 C. 1:1 D. 2:3
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмәюұұКЎёЯ¶юЙПС§ЖЪЖЪД©ҝјКФ»ҜС§КФҫнЈЁҪвОц°жЈ© МвРНЈәСЎФсМв
Ј®ПВБРёчЧйАлЧУЦРДЬҙуБҝ№ІҙжЈ¬ЗТИЬТәОӘОЮЙ«НёГчөДКЗ
AЈ®NaЈ«ЎўHЈ«ЎўNO©Ө 3ЎўSO2©Ө 4 BЈ®NaЈ«Ўў Al3+ ЎўNO©Ө 3 ЎўHCO©Ө 3
CЈ®KЈ«Ўў Cu2Ј«Ўў Cl©ӨЎў A1O©Ө 2 DЈ®Ca2Ј«Ўў Cl©ӨЎўSO2©Ө 3Ўў NH+ 4
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмәюұұКЎИэРЈёЯ¶юЙПС§ЖЪЖЪД©БӘҝј»ҜС§КФҫнЈЁҪвОц°жЈ© МвРНЈәМоҝХМв
ТСЦӘ0.1mol/L H2SO4ФЪЛ®ЦРөДөЪТ»ІҪөзАлКЗНкИ«өДЈ¬өЪ¶юІҪөзАлІўІ»НкИ«ЎЈіЈОВПВУР0.1mol/LөДТФПВјёЦЦИЬТәөДөзАл¶ИЈЁјҙТСҫӯөзАлөД·ЦЧУКэХјФӯАҙ·ЦЧУЧЬКэөД°Щ·ЦКэЈ©ИзПВұнЈ¬»ШҙрПВБРОКМвЈә
ўЩH2SO4ИЬТәЦРөДHSO4ЁC | ўЪNaHSO4ИЬТәЦРөДHSO4ЁC | ўЫCH3COOH | ўЬHClИЬТә |
10ЈҘ | 29ЈҘ | 1.33ЈҘ | 100ЈҘ |
ЈЁ1Ј©РҙіцH2SO4ФЪЛ®ЦРөДөзАл·ҪіМКҪЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎ ЎЎЎЎЎЎЎЎЎЎЎЎЎЎ ЎЎ ЎЎЎЈ
ЈЁ2Ј©іЈОВПВЈ¬МвЙиМхјюПВөДўЩИЬТәЦРc(H+)ЈҪЎЎЎЎЎЎЎЎЎЎ ЎЎЎЈ
ЈЁ3Ј©іЈОВПВЈ¬pHПаН¬өДЙПКцјёЦЦИЬТәЈ¬ЖдОпЦКөДБҝЕЁ¶ИУЙҙуөҪРЎөДЛіРтКЗЈЁМоРтәЕЈ©ЎЎ ЎЈ
ЈЁ4Ј©ИфҪ«10mLМвЙиМхјюПВөДNaHSO4ИЬТәУл0.1mol/LNaOHИЬТәөИМе»э»мәПЈ¬Фт»мәПәуИЬТәЦРАлЧУЕЁ¶ИУЙҙуөҪРЎЛіРтОӘ ЎЈ
ЈЁ5Ј©ёщҫЭМвЙиМхјюјЖЛгCH3COOHөДөзАліЈКэKaЈҪ ЎЈИфіЈОВПВЈ¬Ҫ«b molЎӨLЁC1өДCH3COONaТәУл0.01 molЎӨLЁC1өДСОЛбөИМе»э»мәПЈ¬·ҙУҰҙпЖҪәвКұЈ¬ІвөГИЬТәөДpHЈҪ7Ј¬УГә¬bөДҙъКэКҪұнКҫCH3COOHөДөзАліЈКэKaЈҪ ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмәюұұКЎИэРЈёЯ¶юЙПС§ЖЪЖЪД©БӘҝј»ҜС§КФҫнЈЁҪвОц°жЈ© МвРНЈәСЎФсМв
ПВБРЛө·ЁІ»ХэИ·өДКЗ
AЈ®ИІМюөД№ЩДЬНЕОӘЈӯCЎФCЈӯ BЈ®ТТП©өДҪб№№јтКҪОӘCH2CH2
CЈ®ФЪМъЦЖЖ·ЙП¶ЖНӯКұУГҪрКфНӯЧчСфј« DЈ®УГNa2SЧціБөнјБіэИҘ·ПЛ®ЦРөДCu2+әНHg2+
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмХгҪӯКЎҙИПӘКРёЯ¶юЙПС§ЖЪЖЪД©ІвКФ»ҜС§КФҫнЈЁҪвОц°жЈ© МвРНЈәСЎФсМв
ПВБРұд»ҜЦРЈ¬ұШРлјУИл»№ФӯјБІЕДЬ·ўЙъөДКЗ
AЈ®FeCl2ЎъFeCl3 BЈ®H2OЎъH2 CЈ®AlЎъNaAlO2 DЈ®CO2ЎъC
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com