
| 1000ρw |
| M |
| n |
| V |
| 1000ρw |
| M |
| 1000×1.18×36.5% |
| 36.5 |
| 0.25L×0.1mol/L |
| 11.8mol/L |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
| A、①②⑤ | B、 ①②③④⑤ |
| C、①③④ | D、⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |



查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 2014年10月初,雾霾天气多次肆虐河北、天津、北京等地区.其中,燃煤和汽车尾气是造成空气污染的原因之一.
2014年10月初,雾霾天气多次肆虐河北、天津、北京等地区.其中,燃煤和汽车尾气是造成空气污染的原因之一.| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
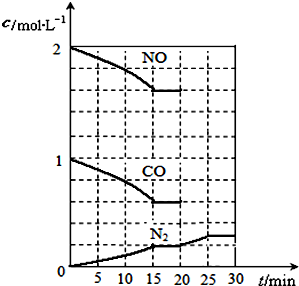 二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染.
二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com