
分析 (1)根据盖斯定律,反应热只与始态与终态有关,与途径无关,始态相同、终态相同反应热相同;
(2)根据盖斯定律,利用途径Ⅱ构造途径Ⅰ,进行计算.
解答 解:(1)根据盖斯定律,煤作为燃料不管是一步完成还是分两步完成,反应物和产物的焓值是一定的,所以两途径的焓变值一样,放出的热量一样,
故答案为:等于;
(2)途径Ⅰ:①C(s)+O2(g)═CO2(g)△H=-a kJ•mol-1
途径Ⅱ:②C(s)+H2O(g)═CO(g)+H2(g)△H=+b kJ•mol-1
③2CO(g)+O2(g)═2CO2(g)△H=-c kJ•mol-1
④2H2(g)+O2(g)═2H2O(g)△H=-d kJ•mol-1
根据盖斯定律:②+③×$\frac{1}{2}$+④×$\frac{1}{2}$得得C(s)+O2(g)═CO2(g),所以-a=b-$\frac{1}{2}$(c+d),所以b=-a+$\frac{1}{2}$(c+d),
故答案为:b=-a+$\frac{1}{2}$(c+d).
点评 本题考查了盖斯定律在热化学方程式中的计算,题目难度中等,明确盖斯定律的含义及应用方法为解答关键,注意掌握热化学方程的书写原则,试题有利于提高学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
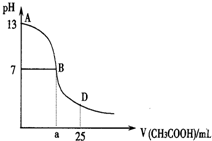 如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )| A. | c(OH-)大于、小于或等于c(CH3COO-) | B. | c(OH-)一定等于c(CH3COO-) | ||
| C. | c(OH-)一定小于c(CH3COO-) | D. | c(OH-)一定大于c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:
天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:时间 物质 | 0min | 20min | 60min | 90min | 120min |
| H2S | 0.006 | 0.005 | |||
| H2 | 0 | 0.002 | 0.004 | ||
| S2 | 0 | 0.002 | 0.0025 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
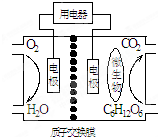
| A. | 该电池能够在高温下工作 | |
| B. | 电池的负极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+ | |
| C. | 放电过程中,H+从正极区向负极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下气体$\frac{2.42}{6}$L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
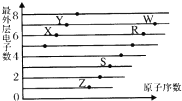 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )| A. | 该图体现出原子核外电子层呈现周期性变化 | |
| B. | 简单离子半径:W->R2->Z+>S3+ | |
| C. | R、Z形成的化合物中可能含有共价键 | |
| D. | 由酸性:HWO4>H2RO3可证明非金属性:W>R |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
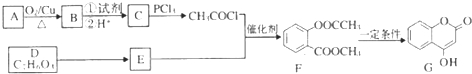
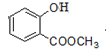
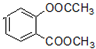 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+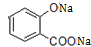 +H2O.
+H2O.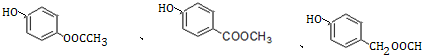 (写出其中一种的结构简式).
(写出其中一种的结构简式).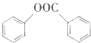 )是一种重要的有机合成中间体,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)
)是一种重要的有机合成中间体,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
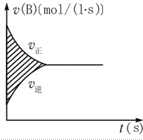
| A. | A浓度的减小量 | B. | B浓度的减小量 | ||
| C. | C物质的量的增加量 | D. | B物质的量的减少量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com