
��18�֣����������ҹ��ĵ��ӹ�ҵѸ�ٷ�չ������˴����ĵ�·��ʴ�̷�Һ�IJ������ŷš�ʴ��Һ��Ҫ�����Եģ�HCl��H2O2�������Եģ�NH3��NH4Cl���Լ���ͳ�ģ�HCl��FeCl3����3�֡�ʴ�̷�Һ�к��д�����Cu2+����Һ�Ļ������ÿɼ���ͭ��Դ����ʧ������ʴ�̷�Һ�ij��ô����������£�
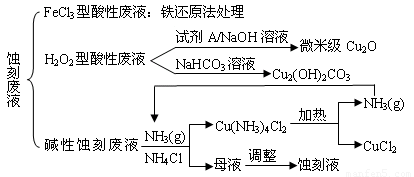
�� FeCl3�����Է�Һ�û�ԭ������������Fe��Cl2�ֱ���Ϊ��ԭ�������������ɻ���ͭ��ʹʴ��Һ��������������Ҫ��ѧ��Ӧ�У�Fe+Cu2+=Fe2++Cu��Fe+2H+=Fe2++H2������
������������ ������������ ���������ӷ���ʽ��ʾ����
�� HCl��H2O2��ʴ��Һʴ�̹����з����Ļ�ѧ��Ӧ�û�ѧ����ʽ�ɱ�ʾΪ��
���������� ��
�� H2O2�����Է�Һ����������Cu2O�����У�������Լ�A�����ѡ���������е����������� ������ţ�
������KMnO4��Һ ��NaCl(��) �������� �ܼ�ȩ
�� ����H2O2�����Է�Һ����Cu2(OH)2CO3�Ĺ���������Ʒ�Ӧ���¶ȣ����¶ȸ���80��ʱ����Ʒ��ɫ��������ԭ����������������� ��
�� ����ʴ��Һ�����Ļ�ѧ��Ӧ�ǣ�2Cu+4NH4Cl+4NH3��H2O+O2 = 2Cu(NH3)4Cl2+6H2O����������ʴ�̷�Һ�����м���NH4Cl���岢ͨ��NH3��Ŀ�������������� ��
 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��12�֣����������ҹ��ĵ��ӹ�ҵѸ�ٷ�չ������˴����ĵ�·��ʴ�̷�Һ�IJ������ŷš�ʴ��Һ��Ҫ�����Եģ�HCl��H2O2�������Եģ�NH3��NH4Cl���Լ���ͳ�ģ�HCl��FeCl3����3�֡�ʴ�̷�Һ�к��д�����Cu2+����Һ�Ļ������ÿɼ���ͭ��Դ����ʧ������ʴ�̷�Һ�ij��ô����������£�
�� FeCl3�����Է�Һ�û�ԭ������������Fe��Cl2�ֱ���Ϊ��ԭ�������������ɻ���ͭ��ʹʴ��Һ��������������Ҫ��ѧ��Ӧ�У�Fe+Cu2+=Fe2++Cu��Fe+2H+=Fe2++H2������
������ ���� ������ ���� ���������ӷ���ʽ��ʾ����
�� HCl��H2O2��ʴ��Һʴ�̹����з����Ļ�ѧ��Ӧ�û�ѧ����ʽ�ɱ�ʾΪ��
���� �� �� ��
�� H2O2�����Է�Һ����������Cu2O�����У�������Լ�A�����ѡ���������е��� ���� ������ţ�
������KMnO4��Һ ��NaCl(��) �������� �ܼ�ȩ
�� ����H2O2�����Է�Һ����Cu2(OH)2CO3�Ĺ���������Ʒ�Ӧ���¶ȣ����¶ȸ���80��ʱ����Ʒ��ɫ��������ԭ����������� ���� ��
�� ����ʴ��Һ��ʴ�̹����з����Ļ�ѧ��Ӧ�ǣ�2Cu+4NH4Cl+4NH3��H2O+O2= 2Cu(NH3)4Cl2+6H2O����������ʴ�̷�Һ�����м���NH4Cl���岢ͨ��NH3��Ŀ�������� ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012�콭��ʡ������ѧ������ѧ��10�·��¿���ѧ�Ծ� ���ͣ�ʵ����
��18�֣����������ҹ��ĵ��ӹ�ҵѸ�ٷ�չ������˴����ĵ�·��ʴ�̷�Һ�IJ������ŷš�ʴ��Һ��Ҫ�����Եģ�HCl��H2O2�������Եģ�NH3��NH4Cl���Լ���ͳ�ģ�HCl��FeCl3����3�֡�ʴ�̷�Һ�к��д�����Cu2+����Һ�Ļ������ÿɼ���ͭ��Դ����ʧ������ʴ�̷�Һ�ij��ô����������£�
�� FeCl3�����Է�Һ�û�ԭ������������Fe��Cl2�ֱ���Ϊ��ԭ�������������ɻ���ͭ��ʹʴ��Һ��������������Ҫ��ѧ��Ӧ�У�Fe+Cu2+=Fe2++Cu��Fe+2H+=Fe2++H2������
������������ ������������ ���������ӷ���ʽ��ʾ����
�� HCl��H2O2��ʴ��Һʴ�̹����з����Ļ�ѧ��Ӧ�û�ѧ����ʽ�ɱ�ʾΪ��
���������� ��
�� H2O2�����Է�Һ����������Cu2O�����У�������Լ�A�����ѡ���������е����������� ������ţ�
������KMnO4��Һ ��NaCl(��) �������� �ܼ�ȩ
�� ����H2O2�����Է�Һ����Cu2(OH)2CO3�Ĺ���������Ʒ�Ӧ���¶ȣ����¶ȸ���80��ʱ����Ʒ��ɫ��������ԭ����������������� ��
�� ����ʴ��Һ�����Ļ�ѧ��Ӧ�ǣ�2Cu+4NH4Cl+4NH3��H2O+O2 = 2Cu(NH3)4Cl2+6H2O����������ʴ�̷�Һ�����м���NH4Cl���岢ͨ��NH3��Ŀ�������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���㽭ʡ������ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
��12�֣����������ҹ��ĵ��ӹ�ҵѸ�ٷ�չ������˴����ĵ�·��ʴ�̷�Һ�IJ������ŷš�ʴ��Һ��Ҫ�����Եģ�HCl��H2O2�������Եģ�NH3��NH4Cl���Լ���ͳ�ģ�HCl��FeCl3����3�֡�ʴ�̷�Һ�к��д�����Cu2+����Һ�Ļ������ÿɼ���ͭ��Դ����ʧ������ʴ�̷�Һ�ij��ô����������£�

�� FeCl3�����Է�Һ�û�ԭ������������Fe��Cl2�ֱ���Ϊ��ԭ�������������ɻ���ͭ��ʹʴ��Һ��������������Ҫ��ѧ��Ӧ�У�Fe+Cu2+=Fe2++Cu��Fe+2H+=Fe2++H2������
������ ���� ������ ���� ���������ӷ���ʽ��ʾ����
�� HCl��H2O2��ʴ��Һʴ�̹����з����Ļ�ѧ��Ӧ�û�ѧ����ʽ�ɱ�ʾΪ��
���� �� �� ��
�� H2O2�����Է�Һ����������Cu2O�����У�������Լ�A�����ѡ���������е��� ���� ������ţ�
������KMnO4��Һ ��NaCl(��) �������� �ܼ�ȩ
�� ����H2O2�����Է�Һ����Cu2(OH)2CO3�Ĺ���������Ʒ�Ӧ���¶ȣ����¶ȸ���80��ʱ����Ʒ��ɫ��������ԭ����������� ���� ��
�� ����ʴ��Һ��ʴ�̹����з����Ļ�ѧ��Ӧ�ǣ�2Cu+4NH4Cl+4NH3��H2O+O2 = 2Cu(NH3)4Cl2+6H2O����������ʴ�̷�Һ�����м���NH4Cl���岢ͨ��NH3��Ŀ�������� ���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com