
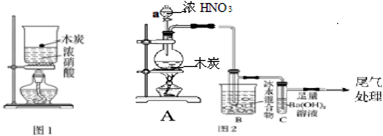
分析 (1)浓硝酸具有强氧化性,碳具有还原性,两者发生氧化还原反应生成二氧化碳、二氧化氮和水,根据得失电子守恒和原子守恒书写化学反应方程式;
(2)红棕色气体为二氧化氮气体,浓硝酸不稳定,易分解生成二氧化氮,可能为硝酸的分解生成的二氧化氮,因硝酸分解无二氧化碳生成,而碳和硝酸反应有二氧化碳,所以需检验二氧化碳的存在进行分析;
(3)①根据仪器的构造和常见仪器的名称进行解答;
②根据四氧化二氮的熔点:-9.3℃可知,2NO2?N2O4,正反应为放热反应,温度低,平衡向生成四氧化二氮的方向移动;
③水的熔点为0℃,四氧化二氮的熔点:-9.3℃,为排除干扰,应在图2装置A、B之间增加一个干燥酸性气体的装置;
(4)二氧化碳能和氢氧化钡溶液反应生成难溶性的碳酸钡,证明有二氧化碳存在,从而证明了木炭与浓硝酸在加热条件下能发生反应.
解答 解:(1)浓硝酸具有强氧化性,碳具有还原性,两者发生氧化还原反应,氮从+5降为+4价,碳从0价升为+4价,转移电子数为4,所以硝酸前面系数为4,反应为:C+4HNO3(浓)$\frac{\underline{\;△\;}}{\;}$4NO2↑+CO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;△\;}}{\;}$4NO2↑+CO2↑+2H2O;
(2)浓硝酸不稳定,加热易分解生成二氧化氮,反应方程式为4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,浓硝酸和碳在加热条件下反应也生成二氧化氮,C+4HNO3(浓)$\frac{\underline{\;△\;}}{\;}$4NO2↑+CO2↑+2H2O,所以对实验造成干扰,所以要想检验浓硝酸和碳反应不能根据是否生成二氧化氮判断,要根据CO2判断,
故答案为:4HNO3(浓)$\frac{\underline{\;△\;}}{\;}$4NO2↑+O2↑+2H2O;CO2;
(3)①玻璃仪器a具有球形特征并带有玻璃活塞,为分液漏斗,
故答案为:分液漏斗;
②根据题给信息知,-9.3℃时四氧化二氮为液体,所以温度越低,二氧化氮越向四氧化二氮方向移动,所以要使用冰水混合物冷却二氧化氮气体,从而将混合气体中的二氧化氮除去,防止干扰二氧化碳的检验,
故答案为:常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,从而除去混合气体中的NO2;
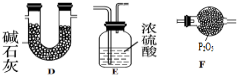
③无论是硝酸分解,还是碳和硝酸反应,产物中都有水,四氧化二氮为酸性气体,水的熔点为0℃,四氧化二氮的熔点:-9.3℃,为排除干扰,应在图2装置A、B之间增加一个干燥酸性气体的装置,E、F符合,
故答案为:E、F;
(4)二氧化碳能和氢氧化钡溶液反应生成难溶性的碳酸钡,所以看到的现象是:C中溶液变浑浊,或产生白色沉淀,证明有二氧化碳存在,从而证明了木炭与浓硝酸在加热条件下能发生反应,
故答案为:溶液变浑浊(或产生白色沉淀).
点评 本题考查探究木炭与浓硝酸性质实验,为高频考点,把握图中装置的作用、反应原理及实验技能为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 元素的非金属性较强,其单质也越活泼 | 磷单质比N2稳定 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓硝酸、稀硝酸,浓硝酸中铝片先溶解完全 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS黑色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I-、H+、Cl-、NO3- | B. | Al3+、K+、OH-、Ba2+ | ||
| C. | Mg2+、Fe3+、Cl-、NO3- | D. | Ca2+、SO42-、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原NaBr溶液分层,上层液体呈现橙色 | |
| B. | 原NaBr溶液分层,下层液体呈现橙色 | |
| C. | 原KI溶液分层,上层几乎无色 | |
| D. | 原KI溶液分层,下层呈现紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(Na2S)>pH(NaCN)>pH(NaHS)>pH(CH3COONa) | |
| B. | 用0.1mol/L的NaOH溶液滴定PH值相等的CH3COOH和HCN溶液,CH3COOH消耗的NaOH溶液体积更大 | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)+c(H2S) | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-d mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+H2SO4(稀) | B. | Cu+HNO3(浓) | C. | Fe+HNO3(稀) | D. | C+H2SO4(浓) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com