
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码)过程 |
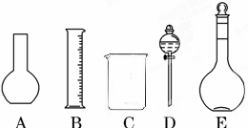
分析 (1)根据配制一定物质的量浓度溶液用到仪器选择;
(2)依据C=$\frac{1000ρω}{M}$计算质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度,依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸体积,依据浓硫酸体积选择合适规格量筒;
(3)浓硫酸稀释应注意将浓硫酸加到水中;
(4)依据配制一定物质的量浓度溶液的一般步骤排序;
(5)依据配制一定物质的量浓度溶液的正确操作步骤判断,根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断;
(6)托盘天平的精确度为0.1g,分度盘的指针偏右,说明右边重;根据使用托盘天平时,加砝码的正确操作完成;
解答 解:(1)配制一定物质的量浓度溶液用的仪器有:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,不需要的仪器有平底烧瓶和分液漏斗,还缺少的仪器:玻璃棒、胶头滴管;
故答案为:AD;玻璃棒、胶头滴管;
(2)质量分数为98%、密度为1.84g/cm3的浓硫酸物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,配制450mL溶液,应选择500mL容量瓶,实际配制500mL溶液,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:V×18.4mol/L=0.5mol/L×0.5L,解得V=0.0136L,即13.6mL,应选择25mL量筒;
故答案为:13.6;②;
(3)浓硫酸稀释的正确操作为:将浓硫酸沿着烧杯壁(或玻璃棒)缓慢倒入水中,并不断用玻璃棒搅拌;
故答案为;将浓硫酸沿着烧杯壁(或玻璃棒)缓慢倒入水中,并不断用玻璃棒搅拌;
(4)配制一定物质的量浓度溶液的一般步骤:计算、称量(量取)、溶解(稀释)、冷却、移液、洗涤、定容、摇匀等,所以正确的操作为:②→①→③→⑧→⑤→⑥→⑦→④;
故答案为:⑧→⑤→⑥→⑦;
(5)①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中,导致量取的浓硫酸体积偏大,硫酸的物质的量偏大,溶液浓度偏高,操作错误;
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,浓硫酸稀释产生大量的热,冷却后溶液体积偏小,溶液浓度偏高,操作错误;
③浓硫酸稀释应将浓硫酸倒入水中,操作错误;
④定容时,加蒸馏水超过标线,又用胶头滴管吸出,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,操作错误;
⑤转移前,容量瓶中含有少量蒸馏水,操作正确,对溶液浓度无影响;
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,导致溶液体积偏大,溶液浓度偏低,操作错误;
⑦定容时,俯视标线,导致溶液体积偏小,溶液浓度偏高,操作错误;
所以:操作错误的为:①②③④⑥⑦;能引起误差偏高的有①②⑦;
故答案为:①②③④⑥⑦;①②⑦;
(6)分度盘的指针偏右,说明右边重,左盘高于右盘;托盘天平的精确度为0.1g,故应为32.6g;根据先加质量大的砝码,再加小的砝码原则,先选择50g砝码,质量偏大,再换20g砝码,砝码质量不足,再加20g砝码,砝码质量偏大,再用10g砝码,砝码质量不足,增加5g砝码,砝码质量偏大,再调节右码到2.2g,
故答案为:高于;将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡;32.6g;
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码过程 | ↓↑ | ↓ | ↓↑ | ↓ | ↓↑ |
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意托盘天平使用方法,题目难度不大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:实验题
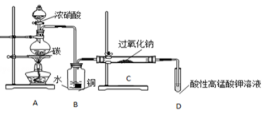 亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组进行下面实验探究,查阅资料知道:
亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组进行下面实验探究,查阅资料知道:| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH+OH-═HCOO-+H2O | B. | CO2+H2O?ΗCΟ3-+H+ | ||
| C. | CO32-+H2O?ΗCΟ3-+OH- | D. | HS-+H2O?S2-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
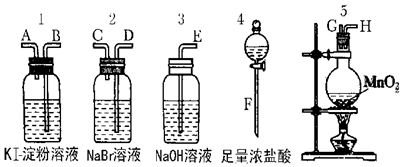
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F-的结构示意图: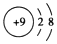 | |
| B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| C. | S2-的结构示意图: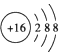 | |
| D. | 原子核内有18个中子的氯原子:${\;}_{17}^{35}$Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com